Почему сладкие растворы липкие?

Водородные связи между молекулами сахара и воды делают растворы сахара "липкими". Обширные Н-связи увеличивают когезию и адгезию раствора, что, в свою очередь, приводит к его липкости.
Сахарный сироп, кленовый сироп, мед, сахарная вата. Все эти лакомства объединяют две вещи: во-первых, все они являются продуктами растворения сахара в воде, а во-вторых, все они липкие!
Сам по себе сахар — это просто сладкий кристалл, и вода тоже не липкая. Так почему же вода и сахар, соединяясь, дают липкую массу?
Чтобы выяснить, как эти, казалось бы, обычные вещества полностью преобразуются при смешивании, мы должны глубоко изучить их молекулярную структуру.
Более пристальный взгляд на сахар и воду
Структура сахара
"Сахар" - это общий термин, используемый для описания большого количества углеводов. Но пока давайте использовать этот термин для обозначения нашего собственного "столового сахара", также известного как "сахароза".
Сахароза относится к классу молекул, называемых углеводами, поскольку состоит из атомов углерода, водорода и кислорода. Она состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода; отсюда и химическая формула C12H22O11.
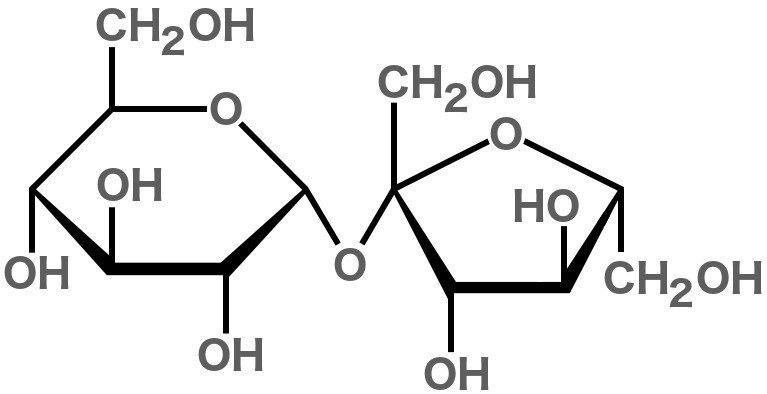
Сахароза считается "дисахаридом", потому что она образуется путем соединения двух моносахаридов (простых сахаров); глюкоза и фруктоза.
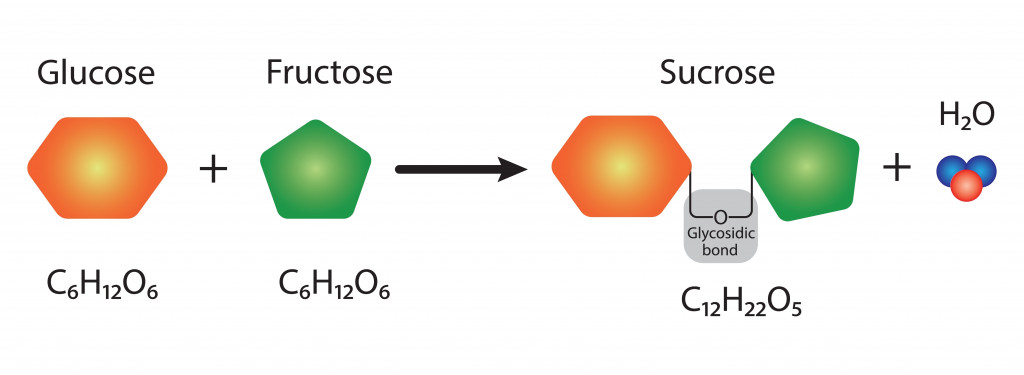
Молекула воды
Вода (H2O) - это молекула, с которой мы все знакомы. Она состоит из двух атомов водорода, ковалентно связанных с атомом кислорода. Несмотря на то, что вода выглядит как простая молекула, ее физические и химические свойства чрезвычайно сложны.
Сравнивая две структуры, мы видим, что у воды и сахара есть нечто общее: обе молекулы имеют связи O-H, и обе молекулы образованы ковалентной связью.
Это основные факторы, обуславливающие липкость сахарного раствора. Ковалентные связи O-H участвуют в так называемом "водородном связывании", которое обеспечивает сахару все те удивительные свойства, которые мы видим.
Ковалентные и ионные молекулы
Конечной целью каждого атома является достижение стабильности, которая достигается за счет полностью заполненной валентной оболочки. Для достижения такой электронной конфигурации атомы используют различные методы;
Ионная связь: эта связь образуется за счет передачи электронов между атомами. Это все равно, что дать свой лишний карандаш другу, у которого его нет. Некоторые атомы отдают свои лишние электроны другим атомам, которые принимают их для достижения стабильности; таким образом, образуя ионную молекулу. Например: соль; NaCL- → NaCL.
Ковалентная связь: Эта связь образуется путем обмена электронами между атомами. В этом случае два связывающихся атома делятся парой электронов, в результате чего образуется ковалентная молекула. Например, сахар, вода.
Ионные и ковалентные молекулы ведут себя в воде по-разному:
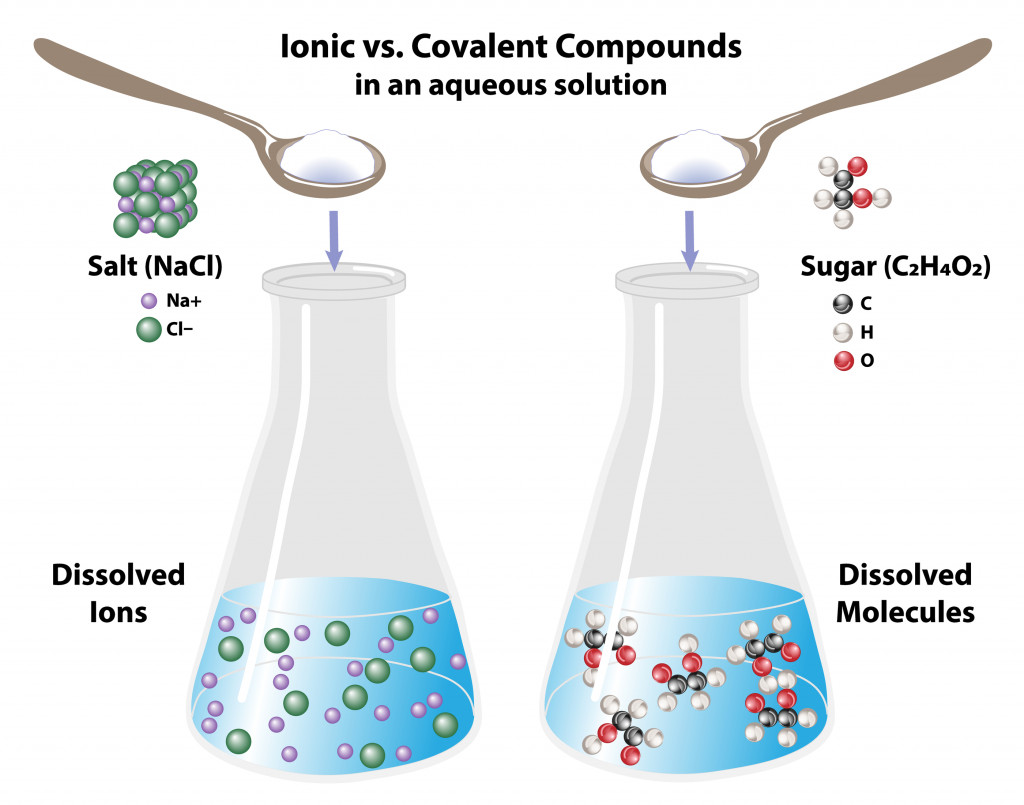
Ковалентные молекулы, такие как сахар, при растворении в воде остаются молекулами, в то время как ионные молекулы, такие как соль, диссоциируют на соответствующие ионы.
Что такое водородная связь?
В ковалентной связи электроны не распределяются поровну между атомами. Связь похожа на перетягивание каната, где побеждает более сильный. Некоторые атомы, такие как кислород, азот и фтор, сильно электроотрицательны; а это значит, что у них есть сила притягивать электроны к себе. В результате в связи один конец будет более отрицательным, чем другой.
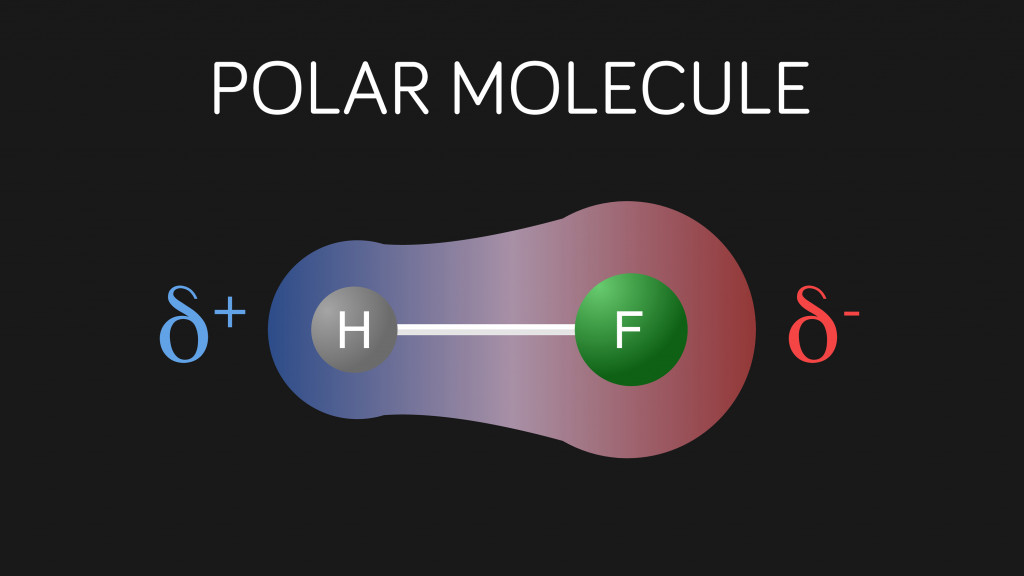
Электроотрицательность кислорода составляет 3,44, в то время как у водорода - 2,20. Следовательно, кислород сильнее притягивает электронную пару. Таким образом, в связи O-H кислород имеет частичный отрицательный заряд, а водород - частичный положительный заряд. Частично положительные атомы H одной молекулы могут электростатически притягивать частично отрицательные атомы O других молекул.
Это межмолекулярное притяжение между атомом водорода (имеющим частичный положительный заряд) и другим электроотрицательным атомом, таким как O, N или F (имеющим частичный отрицательный заряд), называется водородной связью. Как следует из названия, это не совсем "связь", а просто сила притяжения между полярными молекулами. Водородная связь слабее ковалентной, но для межмолекулярной силы она довольно сильна.
Но какое отношение это имеет к липкости?
Липкость воды с сахаром
Вода и сахар по отдельности не являются липкими по двум причинам.
Из-за малого количества связывающих атомов (2 водорода, 1 кислород) и маленького размера молекул воды водородные связи в жидкой воде слабые. Эти Н-связи не удерживают молекулы воды слишком крепко. В результате в жидком состоянии молекулы могут просто проходить мимо друг друга. Именно по этой причине вода легко переносится на любую поверхность и течет без усилий.
По сравнению с водой сахароза является громоздкой молекулой. Она имеет 8 групп -OH, выступающих из углеродной цепи. Это стерическое препятствие затрудняет сближение молекул сахара и образование прочной водородной связи. Более того, поскольку они большие, они не могут легко обтекать друг друга. Поэтому они складываются друг на друга, образуя слабую кристаллическую структуру. Именно поэтому сахар существует в виде хрупкого молекулярного кристалла.
Однако при смешивании воды и сахара происходит нечто интересное. В воде молекулы сахара разлетаются и могут свободно перемещаться. Кроме того, крошечным молекулам H2O довольно легко подобраться к цепочкам OH сахарозы и соединиться с ними посредством водородных связей. Таким образом, сахар и вода постепенно образуют разветвленную сеть водородных связей. В результате образуется липкая, комковатая масса.
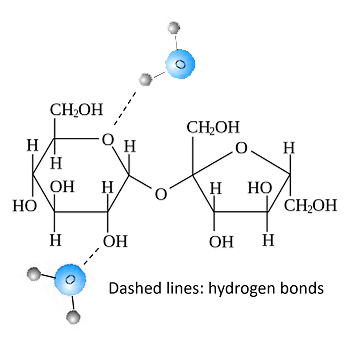
Когезия и адгезия
Водородная связь усиливает два свойства, которые способствуют липкости: когезию и адгезию.
Когезия — это тенденция "похожих" молекул слипаться вместе. Молекулы вода-вода или сахар-сахар в растворе слипаются благодаря когезии. Кроме того, если концентрация сахара высока, когезия молекул сахара возрастает из-за обширной водородной связи. Эта связь также может привести к образованию цепочек сахарозы. Именно поэтому сахарный сироп получается тягучим. Сахарная вата использует эту способность сахара для образования тонких ниток.
Адгезия — это тенденция молекулы прилипать к молекулам другого типа. Связь между сахаром и водой — это адгезия. Аналогично, сахар может прилипать и к другим полярным молекулам. Например, наша кожа — это полярная ткань, и сахар тоже полярный, поэтому они могут "прилипать" друг к другу. Адгезия — это причина, по которой сахарные растворы прилипают к нашим рукам или посуде.
Соотношение когезионных и адгезионных сил определяет общую "липкость" вещества.
Повышенная когезия и адгезия оказывает некоторое сопротивление течению раствора. Это сопротивление жидкости, называемое вязкостью, отвечает за густой, вязкий характер сахарного сиропа или меда.
Теперь мы знаем, почему растворы сахара образуют липкую сладкую массу. Обширная водородная связь между молекулами сахара и воды улучшает когезионные и адгезионные свойства системы и тем самым повышает ее липкость. Вот такая не очень простая химия стоит за липким, клейким сахаром.