Сверхкритическое состояние вещества

Мы говорим о "трех состояниях материи" - твердом, жидком и газе. Но есть и другие: может быть, вы знакомы с плазмой? Но слышали ли вы когда-нибудь о сверхкритическом состоянии (не путать со сверхтекучим, который является еще одним)?
Сверхкритическое состояние не встречается в повседневной жизни, но вполне возможно, что в вашем доме есть вещи, в создании которых участвовали сверхкритические жидкости.
Сверхкритическое состояние
Если мы наблюдаем диаграмму фаз тела, мы отмечаем две замечательные точки: тройную точку, которая является точкой давления-температуры, где это тело может существовать как в твердом, жидком и газообразном виде, и критическую точку:
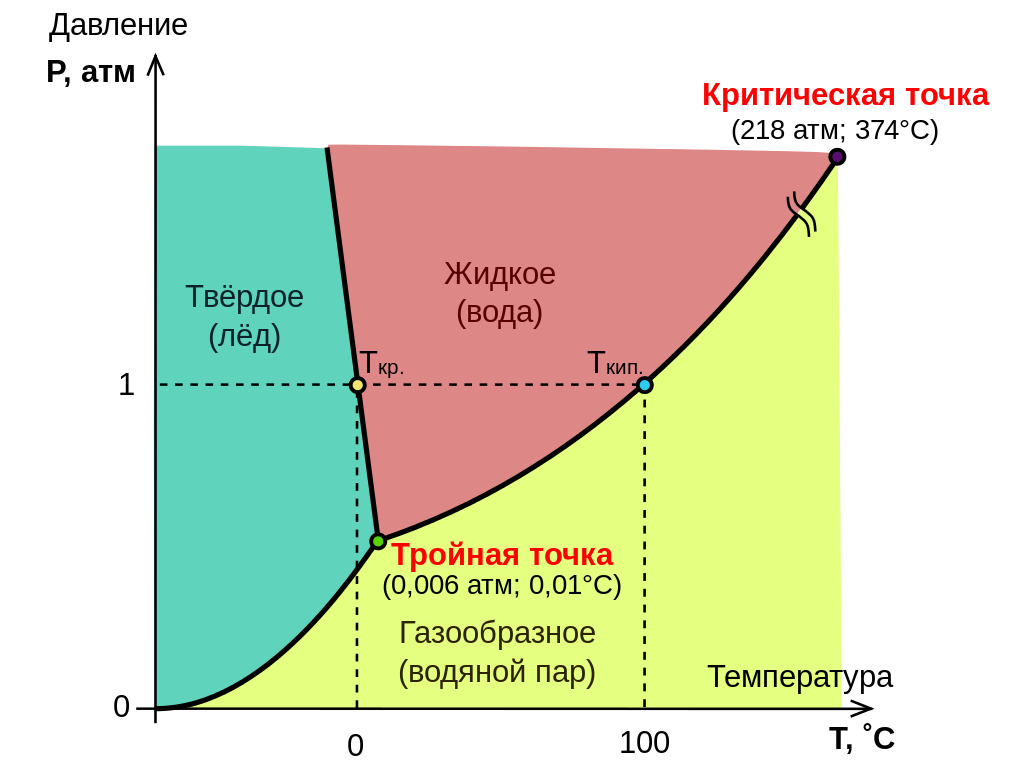
Это критическая точка, которая нас интересует, потому что, если мы ее преодолеем, тело станет сверхкритической жидкостью. Поэтому сверхкритическая жидкость может существовать только при высоких давлениях и высоких температурах.
Чтобы объяснить, что такое сверхкритическая жидкость и как ее получить, давайте проведем мысленный эксперимент.
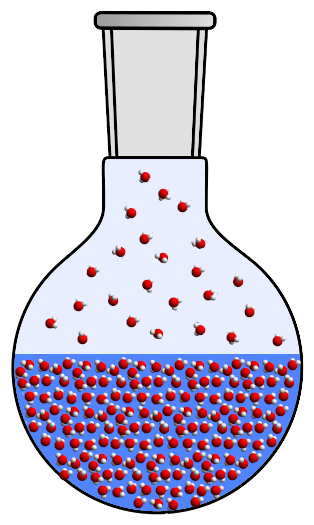
Представьте себе бутылку, наполовину заполненную водой. В этот момент бутылка наполовину наполнена водой и наполовину воздухом. Для нашего эксперимента мы должны начать с вытеснения воздуха: для этого мы подключаем бутылку к вакуумному насосу, который будет вытеснять этот воздух.
Предположим, что бутылка не деформируется: в итоге мы получаем бутылку, содержащую 50% воды и 50% вакуума над ней. За исключением того, что при падении давления вода начнет кипеть, а газированная вода (вода в виде газа, а не газированная вода и с пузырьками) заполнит пустоту. На данный момент бутылка содержит только воду в жидком и газообразном состоянии.
Помните, что в газе молекулы свободны и удалены друг от друга. В жидкости молекулы всегда свободны, но расположены близко друг к другу:
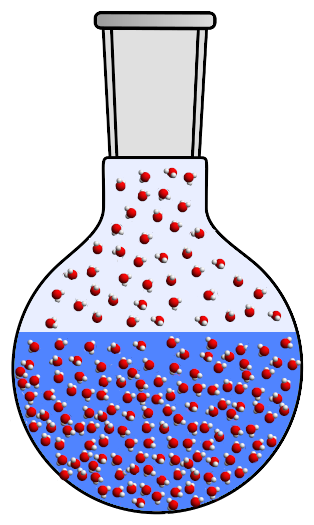
Теперь нагреем бутылку.
Под действием температуры часть жидкости испарится и превратится в газ. Поскольку теперь газа больше, молекулы меньше разнесены : давление растет. Плотность газа, кстати, тоже увеличивается.
В то же время, температура будет расширять жидкость: молекулы в жидкости станут более возбужденными и займут больше места в целом:
Если мы нагреем достаточно, увеличивающаяся плотность газа присоединится к уменьшающейся плотности жидкости: газ и жидкость тогда получат одинаковую плотность! Именно тогда происходит волшебство: две фазы смешиваются, и мы получаем единую жидкость без границы раздела между газом и жидкостью! Эта жидкость называется сверхкритической:
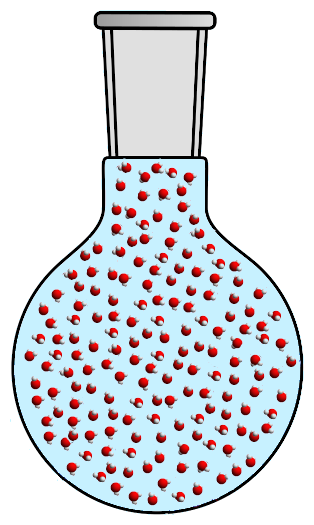
Когда газ и жидкость были разделены, сила тяжести удерживала жидкую фазу ниже, а газовую - вверх. Если две фазы имеют одинаковую плотность, граница раздела исчезает. Нет больше жидкости, нет больше газа: тогда все будет только сверхкритической жидкостью.
Чтобы получить сверхкритическую жидкость при нагревании закрытой бутылки, в бутылке должно быть достаточно жидкости. В противном случае вся жидкость превращается в газ, прежде чем она достигнет критической точки, и у нас будет просто горячий газ. При критической температуре должна быть не испаренная жидкость. Переход от ситуации жидкость + газ к сверхкритической фазе происходит очень быстро, даже внезапно: в течение одного мгновения две фазы исчезают в пользу одной, проходя через короткий момент, когда две фазы сливаются из-за переноса молекул из одной фазы в другую.
При понижении давления и температуры часть жидкости сжимается и снова становится жидкостью. Жидкость упадет на дно бутылки, и мы снова увидим две отдельные фазы.
Эта сверхкритическая фаза может соответствовать чрезвычайно сжатому газу или сверхрелаксированной жидкости, но она все же имеет определенные свойства, которые отличают ее от одного, как от другого.
Свойства сверхкритической жидкости
Сверхкритические жидкости имеют промежуточную плотность между жидкостью и газом. Как далее видно из фазовых диаграмм, они расположены при высоких температурах и давлениях. Для воды, например, необходимо повысить давление до 218 бар и 374 °C! Следовательно, вода в сверхкритическом состоянии встречается не в повседневной жизни.
Вода в сверхкритическом состоянии используется для очистки или дезинтеграции различных отходов: молекулам воды удается полностью разрушить органическое вещество на более мелкие и гораздо менее токсичные молекулы.
Сверхкритические жидкости обычно также имеют более низкие коэффициенты вязкости: их поток менее подвержен механическим потерям. Некоторые концепции электрических генераторов, в том числе ядерных, предусматривают использование сверхкритической воды для вращения турбин реакторов или в качестве теплоносителя, что позволяет значительно повысить энергоэффективность.
Сверхкритический углекислый газ также имеет применение в промышленности. Его гораздо легче получить, чем воду, потому что достаточно всего 74 бара и 31 °C. В дополнение к (сухой) чистке, как и в случае с водой, и ее стерилизующим свойствам, он используется в качестве растворителя, как выгодная замена обычным органическим растворителям. Сверхкритический CO2 остается простым газообразным CO2, как только давление снижается, и он испаряется, не оставляя никаких следов.
Типичный пример - извлечение кофеина из кофе для производства кофе без кофеина. Традиционный метод использовал органические растворители, следы которых могли оставаться в готовом продукте, что не было идеальным. То же замечание в отношении экстракции ароматов и эссенций или других молекул растений в парфюмерии или фармацевтике.
И наоборот, пигменты также можно предварительно разбавить в сверхкритическом CO2 с целью, например, окрашивания текстиля: эта технология обеспечивает преимущество, заключающееся в том, что требуется гораздо меньше воды и опасных продуктов в секторе, который в остальном особенно загрязняет окружающую среду и требует воды.
Последним примером сверхкритической жидкости, которую мы обычно видим в классах или музеях, является сверхкритический гексафторид серы. Он используется для демонстраций "широкой публики", потому что его очень просто получить: "только" 38 бар и 46°C.