Что такое молекула?
На протяжении тысячелетий ученые размышляли над загадкой жизни, а именно над тем, из чего она создается? Согласно большинству древних культур, жизнь и все сущее состояли из основных элементов природы - Земли, Воздуха, Ветра, Воды и Огня. Однако со временем многие философы начали выдвигать идею о том, что все вещи состоят из крошечных неделимых вещей, которые нельзя ни создать, ни уничтожить (т.е. частицы).
Однако это было в значительной степени философское понятие, и только с появлением атомной теории и современной химии ученые начали постулировать, что частицы, взятые в сочетании, производят основные строительные блоки всех вещей. Молекулы, как они их называли, взяты из латинского "moles" (что означает тяжесть, глыба, громада, массивная структура — с уменьшительным суффиксом -cula). Но используемый в контексте современной теории частиц термин относится к малым единицам массы.
Определение:
По классическому определению молекула - это наименьшая частица вещества, сохраняющая химические и физические свойства этого вещества. Она состоит из двух или более атомов, группы подобных или различных атомов, удерживаемых вместе химическими силами.
В космосе обнаружены как простые, так и сложные органические (углеродосодержащие) молекулы. Углерод образуется в ядрах красных гигантских звезд, где он циркулирует на поверхности и распределяется в пространстве.

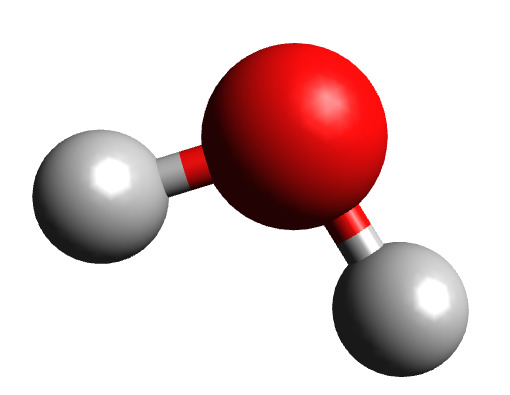
Она может состоять из атомов одного химического элемента, как в случае с кислородом (O2), или из различных элементов, как в случае с водой (H2O). Как компоненты материи, молекулы распространены в органических веществах (и, следовательно, в биохимии) и являются тем, что позволяет создавать жизнетворные элементы, таким как жидкая вода и воздухопроницаемые атмосферы.
Типы связей:
Молекулы удерживаются вместе одним из двух типов связей - ковалентными связями или ионными связями. Ковалентная связь - это химическая связь, которая включает обмен электронными парами между атомами. Связь, которую они образуют, является результатом стабильного баланса сил притяжения и отталкивания между атомами, известна как ковалентная связь.
Ионная связь, напротив, представляет собой тип химической связи, которая включает электростатическое притяжение между противоположно заряженными ионами. Ионы, участвующие в такой связи, — это атомы, которые потеряли один или несколько электронов (называемые катионами), и те, которые приобрели один или несколько электронов (называемые анионами). В отличие от ковалентности, этот перенос называется электровалантом.
В простейших формах ковелантные связи возникают между атомом металла (как катион) и атомом неметалла (анион), что приводит к таким соединениям, как хлорид натрия (NaCl) или оксид железа (Fe²O³), также известные как. соль и ржавчина. Однако могут быть сделаны и более сложные устройства, такие как аммоний (NH 4+) или углеводороды, такие как метан (CH 4) и этан (H 3 CCH 3).
История
Исторически молекулярная теория и атомная теория тесно переплетены. Первые упоминания о том, что материя состоит из “отдельных единиц”, появились в Древней Индии, где последователи джайнизма придерживались идеи, что все вещи состоят из мелких неделимых элементов, которые, соединяясь, образуют более сложные объекты.
В Древней Греции философы Левкипп и Демокрит ввели термин "атомос", имея в виду "мельчайшие неделимые части материи", от которых мы получаем современный термин "атом".
Затем в 1661 году натуралист Роберт Бойл в трактате по химии под названием "Скептический химик" утверждал, что материя состоит из различных комбинаций "корпускул" (устаревший термин для обозначения мельчайшей частицы материи), а не земли, воздуха, ветра, воды и огня. Однако эти наблюдения ограничивались областью философии.
Только в конце 18-го и начале 19-го веков Закон сохранения массы Антуана Лавуазье и Закон множественных пропорций Дальтона привели атомы и молекулы в область точной науки. Первые предположили, что элементы являются основными веществами, которые не могут быть подвергнуты дальнейшему разложению, в то время как последние предположили, что каждый элемент состоит из одного уникального типа атома и что они могут соединяться вместе, образуя химические соединения.

Еще одна находка пришла в 1865 году, когда Иоганн Йозеф Лошмидт измерил размер молекул, составляющих воздух, что дало ощущение масштаба молекул. Изобретение сканирующего туннельного микроскопа (СТМ) в 1981 году позволило впервые непосредственно наблюдать атомы и молекулы.
Сегодня наше понятие молекул получает дальнейшее развитие благодаря постоянным исследованиям в области квантовой физики, органической химии и биохимии. А когда речь заходит о поисках жизни в других мирах, необходимо понимание того, что нужно органическим молекулам, чтобы выйти из комбинации химических строительных блоков.