Ферроптоз
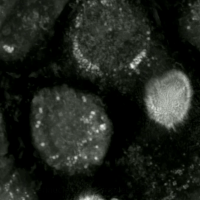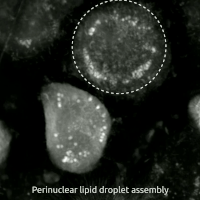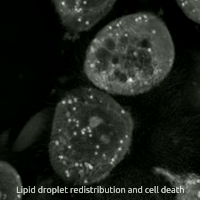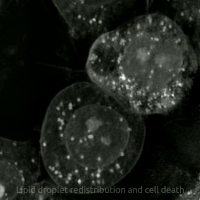
Ферроптоз представляет собой регулируемую форму гибели клеток, уникальную своей зависимостью от железа и катастрофическим накоплением продуктов перекисного окисления липидов в клеточных мембранах. Этот процесс фундаментально отличается от классических механизмов, таких как апоптоз, некроптоз или аутофагия, как своей биохимией, так и морфологическими проявлениями. Сам термин был предложен Брентом Стоквеллом в 2012 году, объединив корни «феррум» (железо) и «птоз» (падение, гибель).
В основе механизма ферроптоза лежит фатальный дисбаланс между окислительными процессами и антиоксидантной защитой. Главными мишенями для разрушения становятся полиненасыщенные жирные кислоты, входящие в состав фосфолипидов клеточных мембран. Их окисление катализируется либо ферментами липоксигеназами, либо происходит неферментативным путем через так называемую реакцию Фентона, в которой ионы двухвалентного железа генерируют чрезвычайно агрессивные гидроксильные радикалы. Ключевым защитником клетки от этой угрозы выступает система глутатион-пероксидазы 4. Этот фермент использует восстановленный глутатион для нейтрализации опасных липидных пероксидов, превращая их в безвредные спирты. Таким образом, ферроптоз запускается, когда эта защитная система подавляется, например, из-за истощения запасов глутатиона или прямого ингибирования GPX4, либо когда продукция токсичных липидных пероксидов по какой-то причине резко превышает возможности клетки по их обезвреживанию.
Морфологически умирающая от ферроптоза клетка имеет характерный вид. Наиболее яркие изменения происходят в митохондриях: они уменьшаются в размерах, их кристы исчезают, а мембраны чрезмерно уплотняются, вплоть до разрыва внешней оболочки. При этом ядро остается без характерных для апоптоза изменений, таких как фрагментация или конденсация хроматина. Биохимическими маркерами процесса служат накопление продуктов перекисного окисления липидов, таких как малоновый диальдегид, резкое снижение уровня восстановленного глутатиона, увеличение внутриклеточного пула лабильного железа и снижение активности фермента GPX4.
Роль ферроптоза в организме двойственна, охватывая как физиологию, так и патологию. В норме он может участвовать в процессах эмбрионального развития, функционировании иммунной системы и выполнять роль естественного барьера против неконтролируемого роста клеток, выступая в роли опухолевого супрессора. Однако его неконтролируемая активация является звеном в патогенезе многих тяжелых заболеваний. К ним относятся нейродегенеративные болезни, такие как Альцгеймера и Паркинсона, где гибель нейронов связана с железо-зависимым окислительным стрессом. Ферроптоз играет ключевую роль в ишемически-реперфузионных повреждениях, возникающих при инфаркте миокарда или инсульте, когда восстановление кровотока парадоксальным образом усиливает окислительный взрыв. Он также вносит вклад в острые повреждения почек, печени и легких.
Особый интерес представляет двойственная роль ферроптоза в онкологии. С одной стороны, многие раковые клетки для своего выживания и роста адаптируются, подавляя пути, ведущие к ферроптозу, что делает его подавление одним из факторов онкогенеза. С другой стороны, индукция ферроптоза открывает новые терапевтические перспективы, особенно для уничтожения опухолей, устойчивых к традиционным методам, запускающим апоптоз. Стратегии включают использование прямых индукторов, таких как эрастин или RSL3, комбинацию цитотоксических препаратов с блокаторами антиоксидантной системы опухоли, применение наночастиц, доставляющих железо, а также иммунотерапию, поскольку ферроптоз является иммуногенной формой гибели и может стимулировать противоопухолевый иммунный ответ.
Терапевтический потенциал управления ферроптозом не ограничивается онкологией. Ингибиторы этого процесса, известные как ферростатины и липрокстатины, демонстрируют защитный эффект в экспериментальных моделях нейродегенеративных заболеваний, инфаркта и инсульта, предотвращая гибель клеток. Таким образом, ферроптоз из узкого биохимического понятия превратился в одну из самых динамично изучаемых областей биомедицины, предлагая принципиально новые мишени для лечения широкого спектра социально значимых заболеваний.