Азотная кислота [HNO3]: структура Льюиса / свойства / применение

Азотная кислота - это сильная одноосновная кислота с pH около 3,01. Это "липкая" молекула, которая легко впитывается в поверхность, особенно если на поверхности есть вода. По физическому состоянию чистая азотная кислота представляет собой бесцветную жидкость, но более старые образцы часто приобретают желтоватый оттенок из-за разложения на оксиды азота и воду.
Химическая формула азотной кислоты - HNO3, она также известна как aqua fortis, что в переводе с латинского означает «Сильная вода».
Это очень агрессивное и токсичное вещество, которое может вызвать серьезные повреждения кожи при использовании без мер предосторожности. Кислота вступает в реакцию с оксидами, гидроксидами и металлами, такими как серебро, медь и железо, образуя нитратные соли.
Обычно азотная кислота, доступная в магазинах, представляет собой 68-процентный водный раствор. Когда ее концентрация (в воде) превышает 86 процентов, она называется дымящейся азотной кислотой. Она хранится в плотно закрытой емкости в сухом, прохладном и хорошо проветриваемом помещении.
Ниже мы рассмотрим, как производится эта кислота, как она выглядит в молекулярном масштабе, каковы ее химические и физические свойства и где она в основном используется.
Азотная кислота HNO3 свойства
Молярная масса: 63,012 г / моль
Внешний вид: Бесцветная или дымящаяся жидкость желто-красного цвета
Запах: неприятно горький или острый, удушающий
Основание конъюгата: Нитратная
Показатель кислотности (pKa): -1,4
Температура плавления: 231 K или -42 °C.
Температура кипения: 356 K или 83 °C (чистой кислоты).
Плотность: 1,51 г/см3 (чистая кислота); 1,41 г/см3 (68% водный раствор)
Структура
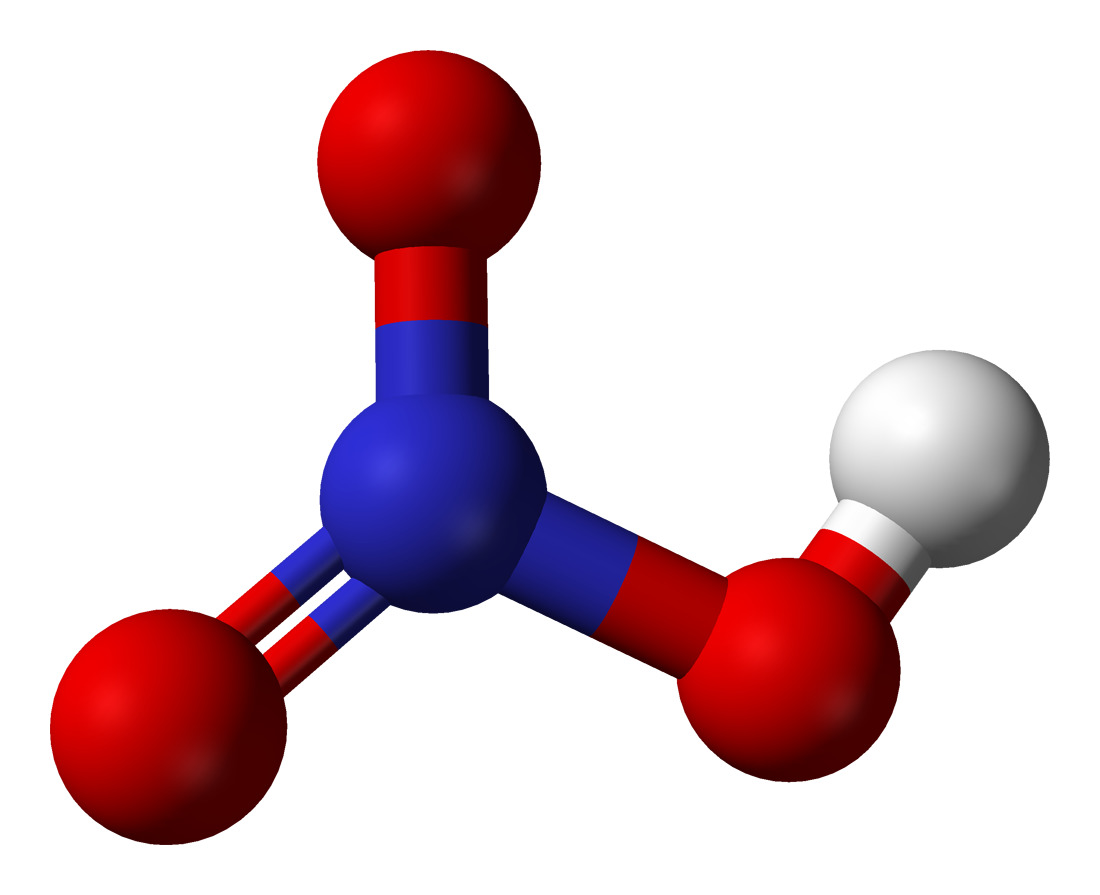
HNO3 имеет один атом азота (синий), один атом водорода (белый) и три атома кислорода (красный). Атом азота связан со всеми тремя атомами кислорода и несет заряд +1. Один атом кислорода несет заряд -1, один связан с водородом, а другой образует двойную связь с азотом.
Поскольку кислород имеет большую тенденцию притягивать к себе общие электроны, чем азот, он несет отрицательный заряд, а атом азота несет положительный заряд.
Структура Льюиса
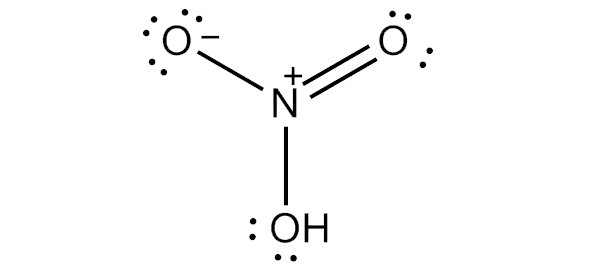
Чтобы нарисовать льюисовскую структуру азотной кислоты, нам нужно подсчитать общее количество валентных электронов в молекуле HNO3.
- Валентный электрон в одном атоме азота = 5
- Валентный электрон в одном атоме водорода = 1
- Валентный электрон в трех атомах кислорода = 18 (6*3)
Это дает нам общее количество валентных электронов (5 + 1 + 18) в одной молекуле HNO3. Поскольку у азота больше валентных электронов, чем у кислорода, мы можем поместить атом азота в центр структуры.
Следующим шагом является формирование связи и маркировка одиночной пары на атомах. Затем идет заряд каждого атома: атом азота получит заряд +2, а два атома кислорода - заряд -1.
Наконец, нам нужно минимизировать заряды на атомах, чтобы сделать структуру стабильной. Это может быть сделано путем преобразования одинокой пары на одном атоме кислорода в связь. Конечная структура состоит из двух одиночных связей между атомом азота и двумя атомами кислорода, а также двойной связи между атомом азота и оставшимся атомом кислорода.
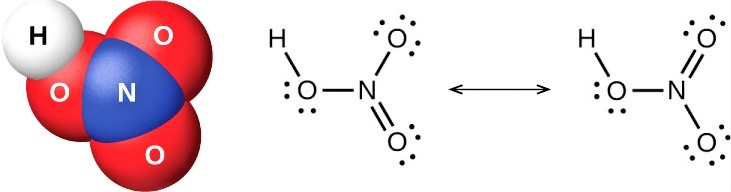
Есть два правильных способа нарисовать структуру Льюиса HNO3. Таким образом, он имеет две основные формы резонанса. Двунаправленная стрелка на изображении выше указывает на то, что существует более одного способа нарисовать структуру азотной кислоты.
Как она производится?
Для производства HNO3 используются два метода. Первый использует окисление, конденсацию и абсорбцию для синтеза слабой HNO3 с концентрациями от 30 до 70 процентов. Второй метод производит сильную HNO3 (с концентрацией 90 процентов) из слабой HNO3 путем объединения процессов обезвоживания, отбеливания, конденсации и абсорбции.
Производство слабой азотной кислоты
Большая часть азотной кислоты образуется в результате высокотемпературного каталитического окисления аммиака. Это называется процессом Оствальда. Он состоит из трех этапов:
1) Окисление аммиака
4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O
Смесь аммиака и воздуха (1:9) окисляется до высокой температуры (750-800 ℃) при прохождении через каталитический преобразователь. Катализатор обычно изготавливается из 90% платины и 10% родиевой сетки. Эта (экзотермическая) реакция приводит к образованию оксида азота и воды в виде пара.
2) Окисление оксида азота
2 NO + O2 → 2 NO2
Окись азота, образовавшаяся в предыдущей реакции, окисляется: она некаталитически реагирует с остаточным кислородом с образованием диоксида азота. Это медленная, однородная реакция, которая сильно зависит от давления и температуры. При высоком давлении и низких температурах эта реакция приводит к образованию максимального количества диоксида азота за очень короткое время.
3) Поглощение
3 NO2 + H2O → 2 HNO3 + NO
В конечной реакции оксид азота поглощается водой. Это дает желаемый продукт (азотную кислоту в разбавленной форме) вместе с оксидом азота. Концентрация HNO 3 зависит от давления, температуры, количества стадий абсорбции, а также от концентрации оксидов азота, поступающих в абсорбер.
Производство сильной азотной кислоты
Высокопрочная HNO 3 получается путем концентрирования слабой HNO 3 экстрактивной дистилляцией. Дистилляция проводится в присутствии дегидратирующего агента, например 60% серной кислоты.
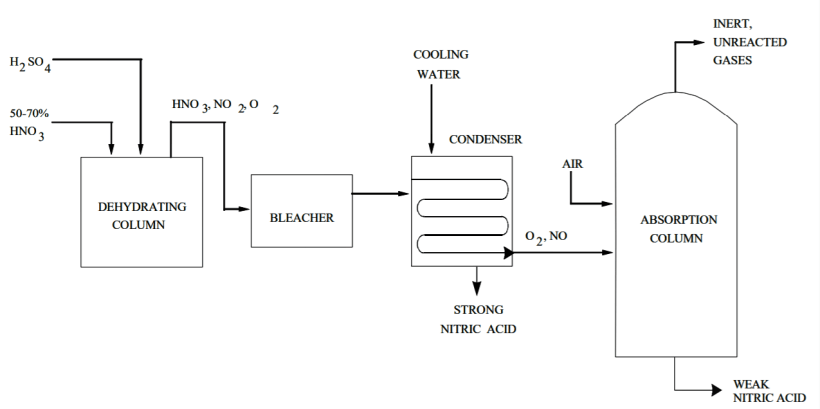
Процесс протекает следующим образом: сильная серная кислота и слабая азотная кислота попадают в насадочную дегидратирующую колонну при атмосферном давлении. Концентрированная HNO 3 выходит из верхней части колонны в виде 99% пара. Он также состоит из небольшого количества кислорода и оксида азота от диссоциации азотной кислоты.
Кислота проходит через отбеливатель и попадает в систему конденсатора, который отделяет ее от оксида азота и кислорода. Абсорбционная колонна забирает эти побочные продукты и объединяет оксид азота со вспомогательным воздухом для получения диоксида азота. Этот газообразный диоксид азота затем рекуперируется в виде слабой HNO 3, а небольшие непрореагировавшие и инертные газы выбрасываются в атмосферу.
Производство в лаборатории
В лаборатории HNO 3 обычно синтезируется путем термического разложения нитрата меди. Это дает оксид меди, диоксид азота и кислород. Последние два пропускаются через воду для получения азотной кислоты.
2 Cu (NO 3 ) 2 → 2 CuO + 4 NO 2 + O 2
А затем реализовать процесс Оствальда
2 NO2 + H2O → HNO2 + HNO3
В последние пару десятилетий исследователи разработали электрохимические средства для получения безводной кислоты из концентрированного HNO 3. Этот процесс осуществляется путем регулирования тока электролиза до тех пор, пока не будут получены необходимые продукты.
Свойства
68% раствор HNO 3 имеет температуру кипения 120,5 °C при давлении 1 атм. С другой стороны, чистая HNO 3 кипит при 83 °C. При комнатной температуре эта концентрированная форма выглядит как бесцветная жидкость.
Поскольку азотная кислота имеет свойство разлагаться на открытом воздухе, ее хранят в стеклянных бутылках.
4 HNO3 → 2 H2O + 4 NO2 + O2
Оксиды азота, образующиеся в результате реакции разложения, полностью или частично растворяются в кислоте, вызывая незначительные изменения давления пара над жидкостью. Когда он остается растворенным, он дает кислотно-желтый цвет или красный при более высоких температурах.
Концентрированная азотная кислота выделяет белые пары при контакте с воздухом, в то время как кислота, растворенная в диоксиде азота, образует красновато-коричневые пары.
По концентрации сильную HNO 3 можно разделить на две группы: красная и белая дымящаяся азотная кислота. Первый содержит 84% азотной кислоты, 13% тетроксида диазота и 1-2% воды. Напротив, белая дымящаяся азотная кислота содержит не более 2% воды и очень небольшое количество растворенного диоксида азота (0,5%).

Среди нескольких важных реакций HNO3 можно выделить следующие –
- Нейтрализация аммиаком с образованием нитрата аммония.
- Нитрование толуола и глицерина с образованием взрывчатого тринитротолуола (TNT) и нитроглицерина соответственно.
- Окисление металлов до соответствующих нитратов или оксидов.
- Приготовление нитроцеллюлозы.
А так как это сильный окислитель, то он бурно реагирует с различными неметаллическими веществами. Продукты таких взрывных реакций зависят от температуры, концентрации кислоты и используемого восстановителя.
Области применения
Химические и физические свойства азотной кислоты делают ее ценным веществом. Она имеет несколько различных применений в различных областях, особенно в химической и фармацевтической промышленности.
Удобрения: Почти 80% производимой азотной кислоты используется для производства удобрений. Точнее, она используется для производства аммиачной селитры (NH 4 NO 3) и кальций-аммиачной селитры, которые находят применение в качестве удобрений.
HNO 3 + NH 3 → NH 4 NO 3
Взрывчатые вещества: аммиачная селитра также используется в качестве взрывчатого вещества в горнодобывающей промышленности, гражданском строительстве, карьерах и других областях применения. Примеры взрывчатых веществ, содержащих нитрат аммония, включают ANFO, Amatol и DBX.
Красители и пластмассы: Нитрат кальция и аммония используется в некоторых упаковках со льдом/гелем в качестве альтернативы аммиачной селитре. Она также используется для производства химикатов и растворов, которые используются в производстве красителей и пластмасс.
Ракетное топливо: красная и белая дымящаяся азотная кислота используется в жидкостных ракетах в качестве окислителя. Во время Второй мировой войны немецкие военные использовали дымящуюся красную азотную кислоту в нескольких ракетах.
Деревообработка: Очень слабая HNO3 (с концентрацией 10%) используется для искусственного старения древесины сосны и клена. Придает дереву винтажный вид с масляной отделкой.
Другие применения: слегка концентрированный раствор под названием Nital используется для травления металла, чтобы выявить его структуру на микроуровне. Рефлюксная азотная кислота используется в процессах очистки углеродных нанотрубок. В электрохимии HNO3 используется в качестве химического легирующего агента для органических полупроводников.
Вопросы и ответы
Проводит ли HNO3 электричество?
Как и другие сильные кислоты, азотная кислота является хорошим проводником электричества. Исследования показывают, что обработка материала этой кислотой может улучшить его электропроводность до 200 раз.
Растворяет ли HNO3 золото?
Азотная кислота не реагирует с некоторыми драгоценными металлами, такими как металлы платиновой группы и чистое золото. Однако она может растворять некоторые сплавы золота, содержащие менее благородные металлы, такие как серебро и медь. Цветное золото, например, растворяется в азотной кислоте и меняет цвет своей поверхности.
Хотя чистое золото не проявляет никакого эффекта при контакте с азотной кислотой, оно реагирует с царской водкой, смесью азотной и соляной кислот, оптимально в молярном соотношении 1:3. Некоторые ювелирные магазины используют азотную кислоту как дешевое средство для быстрого обнаружения сплавов с низким содержанием золота (менее 14 карат).
Как нейтрализуется HNO 3?
При более высоких концентрациях выделение азотной кислоты может быть весьма значительным, и поэтому необходима хорошая вентиляция. Ее можно нейтрализовать любым неорганическим основанием, например, гидроксидом натрия или известью.
Такие реакции нейтрализации выделяют много тепла. Например, нейтрализация 10% раствора азотной кислоты приведет к повышению температуры на 20 °C, а нейтрализация 70% раствора приведет к повышению температуры на 120 °C, что достаточно для того, чтобы вызвать паровые взрывы.