Российские ученые разработали полимерные наночастицы для адресной доставки противоопухолевых препаратов
Ученые Менделеевского университета с участием коллег из Института биоорганической химии РАН, Московского государственного университета и Центра стратегического планирования и управления медико-биологическими рисками здоровью ФМБА России создали полимерные наночастицы, связанные со специфичным белком TRAIL DR5, способным вызывать гибель опухолевых клеток. Этот цитокин адресно взаимодействует с так называемыми «рецепторами смерти» на оболочке поврежденных клеток и вызывает их самоуничтожение (апоптоз). Эксперименты показали, что наноразмерные сферические частицы могут доставлять белок непосредственно к опухоли, усиливая цитокиновый эффект и не нанося вреда здоровым тканям. Статья об этом исследовании опубликована в журнале .
Организм человека постоянно регулирует рост и развитие клеток. Он маркирует те из них, в которых происходят негативные изменения, а потом запускает процесс их самоуничтожения, апоптоз. Важную роль в этом процессе играют белки цитокины, поэтому их давно пробуют использовать в лечении онкологических заболеваний. Так, цитокин TRAIL, открытый ещё 25 лет назад, способен определять и убивать опухолевые клетки, не затрагивая здоровые ткани. Учёные предприняли уже множество попыток поставить его на службу медицине. Однако для этого существует несколько препятствий.
Прежде всего, TRAIL работает не со всеми видами рака, и механизмы устойчивости некоторых опухолевых клеток к этому белку до сих пор до конца не изучены. Ещё одна проблема связана с тем, что из пяти рецепторов клетки, с которыми взаимодействует TRAIL, только два — DR4 и DR5 — способны проводить сигнал апоптоза. Их так и называют — "рецепторами смерти". Когда TRAIL связывается с ними, он подаёт раковой клетке команду к самоуничтожению, но три других рецептора либо задерживают запуск самоуничтожения, либо вовсе блокируют его.
Кроме того, сам организм может не вырабатывать достаточно цитокинов, чтобы подавить рост опухоли. Искусственно введенный TRAIL выводится почками слишком быстро, и за отведённое ему время не успевает сделать свою работу. Чтобы увеличить шансы на уничтожение раковых клеток, исследователи манипулируют аминокислотами в составе TRAIL и создают различные модификации белка, которые с большей вероятностью свяжутся с рецепторами DR4 или DR5 и улучшат его фармакокинетику. А дальше встает вопрос о том, как максимально эффективно доставить этого усовершенствованного бойца из пробирки к опухоли внутри организма.
"Для транспортировки обычного, немодифицированного белка TRAIL уже пытались использовать наночастицы: липосомы, полимеры и другие системы. Мы же в своей работе предложили доставлять с помощью наших самоорганизующихся из амфифильных полимеров наночастиц не простой, а усовершенствованный белок, который нацелен конкретно на взаимодействие с рецептором DR5. Это соединение создали наши коллеги из ИБХ РАН", — говорит заведующий кафедрой технологии химико-фармацевтических и косметических средств РХТУ и один из авторов опубликованной работы Андрей Кусков.
Белок верхом на наночастице
Есть много разных идей, как доставлять лекарственные препараты к органу-мишени. Исследователи из РХТУ используют для этих целей наночастицы из полимера поливинилпирролидона, которому придают свойство амфифильности. Это означает, что его молекулы состоят из двух частей — гидрофильной (водорастворимой) и гидрофобной (жирорастворимой).
В водном растворе молекулы полимера самопроизвольно формируют наноразмерные сферические частицы с гидрофильной поверхностью и гидрофобным ядром. Такие частицы могут захватывать внутрь себя действующее вещество для транспортировки, а благодаря гидрофильной поверхности они лучше принимаются иммунитетом и не выпадают в осадок в кровотоке. Это обеспечивает длительное действие лекарственного средства и отсутствие побочной токсичности. Кроме того, действующее вещество может транспортироваться и снаружи наночастицы, цепляясь к её оболочке. Для этого в гидрофильную часть ПВП вводят дополнительные химические группы, которые служат своеобразными крючками.
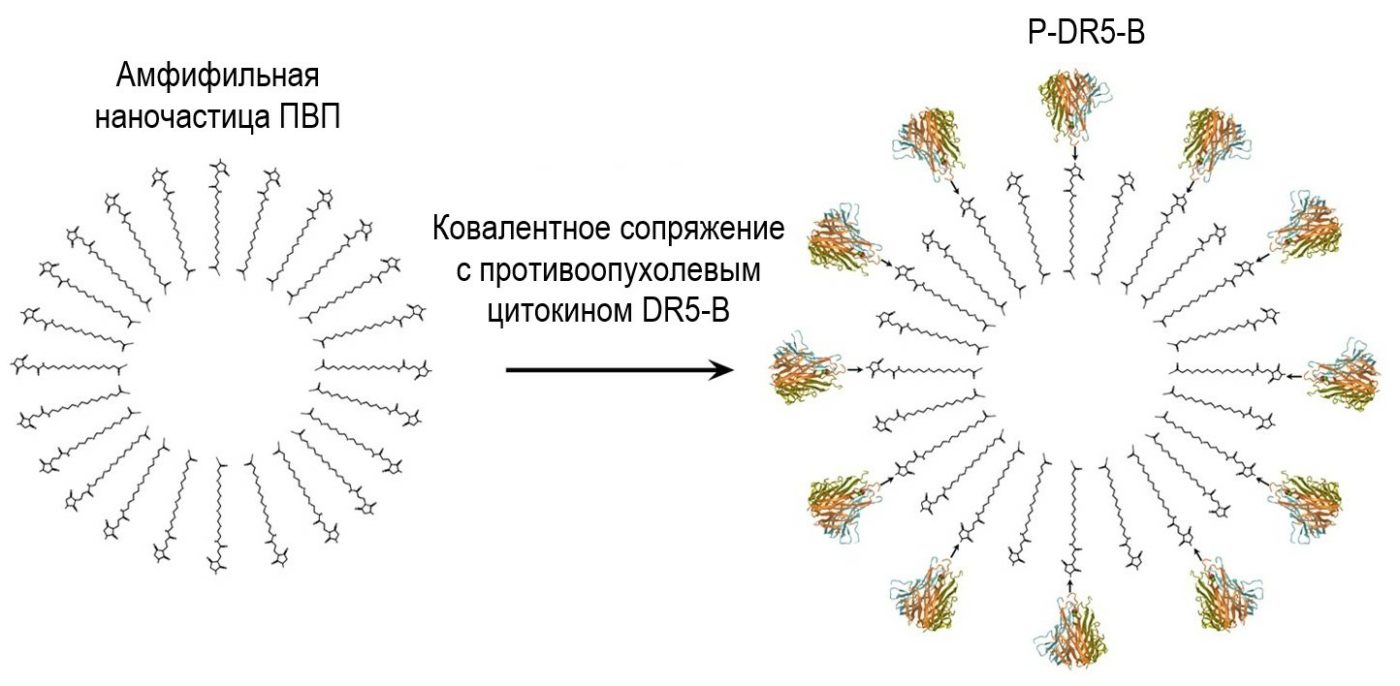
"Молекулы DR5-специфичного цитокина мы прикрепили к оболочке полимерных наночастиц. Для этого на гидрофильные концы полимерной цепи добавили фрагменты, содержащие функциональную группу: одной стороной они присоединены к полимеру, а на другой осталась свободная малеимидная группа для захвата белка. Коллеги из ИБХ также модифицировали свой белок: ввели в него ещё одну аминокислот, специально для реакции с малеимидной группой на оболочке наночастицы. Белок TRAIL DR5-B и наночастицы мы соединяли в максимально мягких условиях, в нейтральной среде и при комнатной температуре", — рассказывает Андрей Кусков.
При таком подходе, отмечает Кусков, в ядро наночастицы можно дополнительно загружать гидрофобные химиотерапевтические препараты, которые усилят работу цитокина, нацеленного на «рецепторы смерти» DR5. Но это уже следующий этап исследований, а пока наноразмерные сферы наполнили модельным веществом — протионамидом, обладающим противотуберкулёзным действием. За счёт этой нагрузки наночастицы получились более стабильными и меньшего размера. Каждая из получившихся частиц P-DR5-B, размером около 200 нанометров, несла на себе несколько молекул противоопухолевого цитокина TRAIL DR5-B. В общей сложности на 1 мг наночастиц пришлось до 5 мкг белка.
Частицы маленькие — эффект большой
Чтобы определить, способны ли наночастицы P-DR5-B убивать опухолевые клетки, ученые провели серию экспериментов. Для исследования были отобраны живые клетки нескольких видов рака толстой кишки и аденокарциномы молочной железы. С клетками колоректального рака рекомбинантный человеческий белок TRAIL в обычных условиях взаимодействует максимально эффективно, а вот клетки рака груди традиционно на него не реагировали. Раствор с наночастицами наносили на монослойные плёнки из клеток, а также на 3D-модели (сфероиды), которые максимально точно имитируют небольшие опухоли, включая их устойчивость к терапии.
"Мы сравнили воздействие на клетки свободных молекул противоопухолевого цитокина TRAIL DR5-B и наших наночастиц, нагруженных этим же белком. Оказалось, что наночастицы P-DR5-B превосходят свободный DR5-B по этому показателю во всех протестированных моделях. Можно говорить о том, что соединение белка с наночастицами усилило его способность убивать опухолевые клетки. Например, в экспериментах с трёхмерными моделями колоректальной аденокарциномы концентрация TRAIL, необходимая для гибели 50% раковых клеток, была для случая P-DR5-B в 10 раз ниже, чем для свободного DR5-B", — говорит Андрей Кусков.

Важно отметить, что здоровые человеческие клетки оказались неповрежденными в обоих случаях, как с чистым DRB-5, так и с полимерными наночастицами P-DR5-B. А вот клетки аденокарциномы молочной железы, наоборот, неожиданно продемонстрировали реакцию на наночастицы с белком. Ученые предполагают, что противоопухолевый эффект наночастиц достигается за счет того, что DR5-специфичный цитокин концентрируется на поверхности носителя и посылает клеткам более мощный сигнал к апоптозу.
Традиционные методы лечения рака (лучевая терапия, химиотерапия, существующая фармакотерапия) обладают негативными эффектами, которые могут не просто подорвать иммунитет, но иногда даже привести к смерти пациента не столько от самой онкологии, сколько от последствий лечения. И в этом смысле противоопухолевая терапия на основе TRAIL может быть очень перспективной: это селективный метод, воздействующий точно и исключительно на опухолевые клетки. Модификация молекул белка и использование полимерных наночастиц в качестве доставщика открывают большие возможности для создания новых безопасных лекарств от рака.
"Наша следующая задача — проверить предположение, что цитокин в виде наночастиц TRAIL DR5-B должен улучшить свою фармакокинетику и циркулировать в крови дольше, чем обычно, чтобы его максимальное количество попало к раковым клеткам. Также мы планируем загрузить ядро наночастиц дополнительно еще одним противоопухолевым препаратом, который имеет иной механизм воздействия на раковые клетки, чтобы достичь синергетического эффекта, и оставить опухолям как можно меньше шансов противостоять такой терапии", — говорит Кусков.