Российские химики научились управлять структурой биокомпозитов с помощью наночастиц
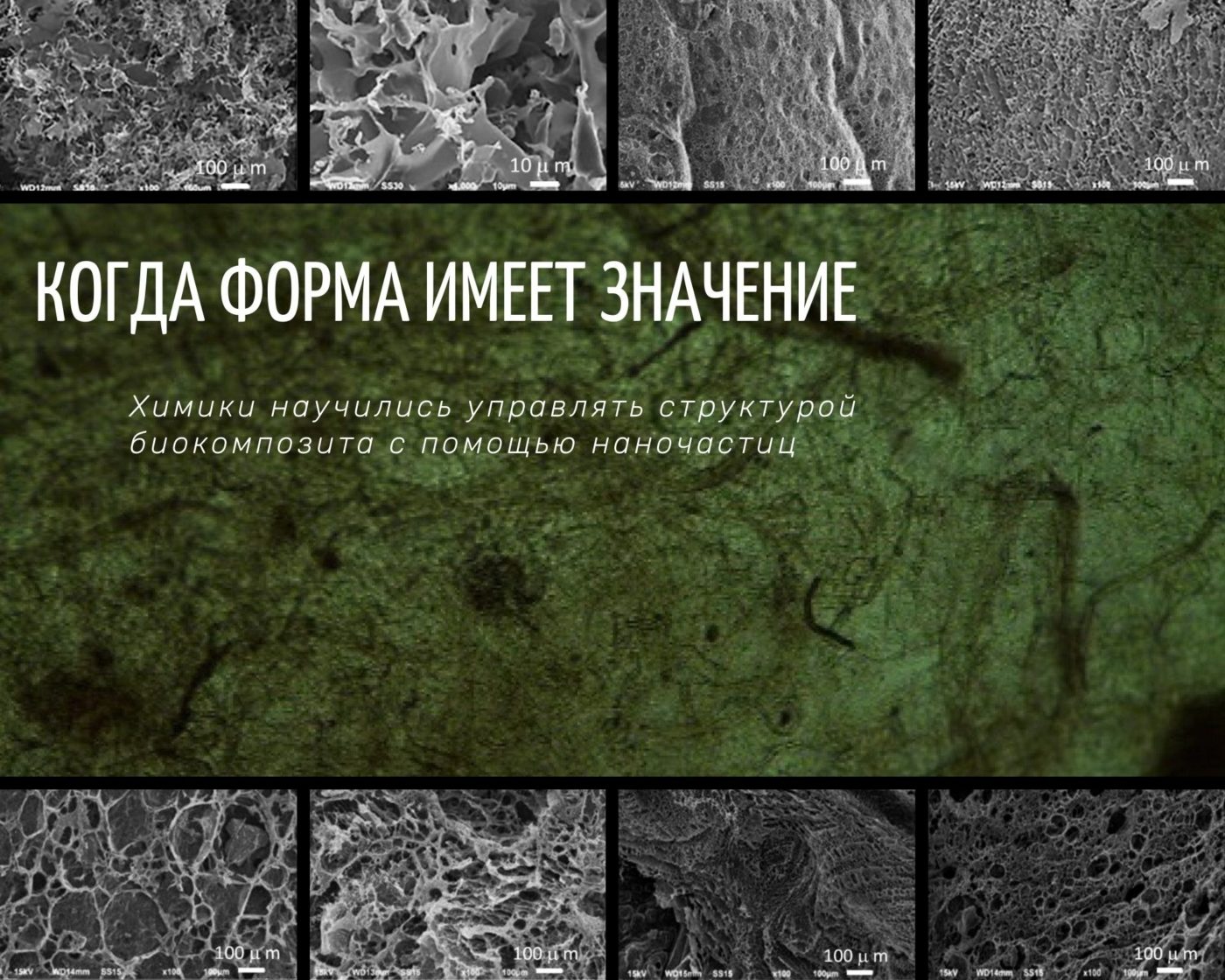
Ученые РХТУ им. Д.И. Менделеева вместе с коллегами из «НМИЦ реабилитации и курортологии» разработали новый биокомпозит на основе двух полимеров с добавлением наночастиц гидроксиапатита. Наночастицы обеспечивают биосовместимость материала, а также обеспечивают формирование необходимой пористой структуры. В перспективе этот гибкий и прочный материал подходит для замены костной ткани в организме человека, а первые эксперименты на клеточных культурах и грызунах показали его хорошую биосовместимость. Результаты исследования опубликованы в .
Чтобы заменять костную ткань в организме регенеративная медицина использует особые материалы - биосовместимые и биодеградируемые. Импланты из этих материалов должны хорошо имитировать структуру и биологические функции живой кости и давать возможность живым клеткам адгезироваться - то есть, прилипать к своей поверхности. В тканевой инженерии уже освоили работу с различными металлами, природными и синтетическими полимерами, биокерамикой. Но у всех этих материалов есть свои минусы. Так, твердые и пористые неорганические материалы не могут обеспечить достаточной упругости, а некоторые полимеры обладают низкой гидрофильностью, что снижает адгезию клеток тканей. Поэтому лучшие материалы для тканевой инженерии - это композиты, сочетающие органику с неорганикой.
Основу материала, который создали в РХТУ, составляют два полимера. Первый - природный полимер альгинат натрия, который получают из водорослей. Он хорошо растворяется в воде, быстро распадается в организме и при этом придает материалу пластичность, делает его гибким. Второй компонент - синтетический, это сополимер полимолочной и полигликолевой кислот (PLGA). Он перерабатывается уже медленней, но также образует естественные метаболиты и одновременно обладает подходящими механическими свойствами. В результате PLGA обеспечивает импланту более длительную жизнь: с ним материал распадается от 4 до 6 месяцев или даже года, давая клеткам живой ткани время прорасти и заменить собой искусственную матрицу.
Третий компонент нового композита - наночастицы кристаллического гидроксиапатита. Это соединение синтезируется самим нашим организмом и составляет основу костей и зубной эмали. Поэтому искусственные гидроксиапатиты уже давно добавляют в материалы различных имплантов, чтобы улучшить адгезию клеток, а также предотвратить гибель клеток и тканей из-за низкой кислотности: гидроксиапатиты могут нейтрализовать кислые продукты биоразрушения скаффолдов — каркасов, которые помогают клеткам воссоздавать заново живую ткань.
Костная ткань одновременно прочная и гибкая. Чтобы искусственный трехмерный скаффолд обладал такими же механическими свойствами и одновременно направлял рост живых клеток, он должен, как и кость, обладать высокопористой структурой, при этом поры должны быть определенных размеров. В новой работе российских химиков пористость структуры задавалась за счет наночастиц кристаллического гидроксиапатита.
"Для получения материала мы смешивали водный раствор одного полимера с наночастицами гидроксиапатита, гомогенизировали эту смесь высокоскоростным миксером, а потом вводили в нее уже сополимер PLGA, растворенный в органическом растворителе, и одновременно вспенивали весь наш состав. После давали смеси затвердеть в течение суток, что происходило за счет испарения органического растворителя и воды. Стабильность пены зависит от соотношения полимеров и концентрации наночастиц гидроксиаппатита. Если пена недостаточно стабильна, то скорость ее оседания выше скорости отвердевания. В этом случае у нас получится плотная желеобразная масса - конечно, в ней не будет подходящих пор. Наночастицы гидроксиапатита обеспечивали стабильность пены: располагаясь на границе сред, они снижают поверхностное натяжение газодисперсной системы, замедляют ее расслаивание, что позволило получить высокопористый композит", — говорит первый автор работы, профессор РХТУ Мария Гордиенко.
Как управлять пеной
На кафедре нанотехнологий и наноматериалов РХТУ умеют получать наночастицы разных форм и размеров. Для этого используют поверхностно-активное вещество цитрат натрия: когда синтез проводят в его присутствии, то в зависимости от концентрации цитрата получаются наночастицы разного размера и даже формы - например, пластинки, палочки или стержни.
Это происходит за счёт того, что ПАВ может пассивировать некоторые грани растущего кристалла, то есть отключать их рост. Так как разные грани имеют разный заряд, то на одни грани цитрат натрия адсорбируется интенсивнее, чем на другие. Это в конечном счёте определяет не только форму наночастиц, но и суммарный заряд частиц - и, как следствие, их поведение на границах фаз.
Еще одна важная характеристика наночастицы - это размер, который определяет ее подвижность в водной среде. Самые мелкие частицы более подвижны. Но из-за этого они стремятся уйти в одну из фаз, а не задерживаются на границе раздела, где их задача - нейтрализовать поверхностное натяжение, чтобы форма пор осталась неизменной при затвердевании пены, а два несмешиваемых раствора (водный раствор альгината натрия и органический раствор сополимера PLGA) более равномерно распределились по объему композита.
Исходные изображения: Michael Yin/Flickr, Journal of Functional Biomaterials / MDPI. Creative Commons
Ученые проверили, какие наночастицы лучше выполняют свои функции на границе сред. Они провели эксперименты с добавлением 0,05 или 0,10 г порошка наночастиц трех типов, а также без добавления наночастиц вообще.
"Мы работали с различными размерами и формами наночастиц гидроксиапатита: с пластинками, стержнями, с агломератами этих форм. В общей сложности за три года проверили около 50 вариантов. В ходе последних экспериментов нашли сочетание, при котором обеспечивается нужная нам структура: большие поры и на их фоне - более мелкие. В этих композитах были использованы наночастицы в форме стержня, средний диаметр - около 10 нанометров, длина - 100-110 нанометров", — поясняет Мария Гордиенко.
Композит с добавлением этих наночастиц при вспенивании образовал поры размером до 100 микрометров (около 0,1 миллиметра). Стенки матрицы были тоньше, чем в других образцах. Также эти композиты лучше себя показали в экспериментах на живых клетках: приживаемость культуры человеческих фибробластов на них составила 60-70%, в то время как для других материалов она не превышала 20%. Данные исследования проводили коллеги Марии Гордиенко из Национального медицинского исследовательского центра реабилитации и курортологии
Испытания на грызунах
Самые перспективные соединения, созданные учеными РХТУ, были проверены на острую токсичность. Для эксперимента на грызунах отобрали три варианта материала с разной формой наночастиц гидроксиапатита. Одной группе грызунов подкожно вводили растворы исследуемых соединений, а контрольной группе - обычный физраствор. В течение 10 суток за животными осуществлялось наблюдение и оценивалось их самочувствие. Вскрытие, которое ученые провели спустя несколько дней, показало, что патологических отклонений у тех, кому вводили экстракт препарата, нет. Значит, составляющие материала не токсичны и не наносят вреда организму.
"В этой работе мы научились управлять процессом создания материала на всех стадиях: от синтеза наночастиц определенной формы до получения композита с порами определенного размера. Теперь нужно понять, какого размера поры максимально подходят для применения нашего материала в регенеративной медицине, но это уже следующий этап, требующий дополнительных экспериментов, в том числе на живых организмах", — заявил Гордиенко.