Почему вода испаряется при комнатной температуре?

В школе нас учили, что когда вода закипает, она меняет фазу с жидкости на пар. Чтобы вызвать это изменение, требуется высокая температура, называемая точкой кипения. Для воды эта точка составляет 100 °C. Однако вспомните, что во время дождя лужи испаряются после прояснения неба, особенно когда выходит солнце. При испарении фаза воды также переходит из жидкой в парообразную, и это происходит при температурах, далеко не равных 100 °C.
Итак ... почему это происходит?
Ответ кроется в физических и химических свойствах молекул воды и связей, образующихся между этими молекулами (межмолекулярных связей).
Химические свойства молекул воды
Молекула воды состоит из двух атомов водорода, соединенных с одним атомом кислорода. Связи между атомами O и H образуются за счет обмена электронами. Эти связи называются ковалентными. Каждый элемент стремится достичь энергетически наименьшего состояния (т.е. наиболее стабильного состояния), теряя или приобретая электроны, чтобы достичь ближайшей конфигурации благородного газа.
Кислород содержит шесть электронов во внешней оболочке и нуждается в двух электронах, чтобы завершить октет и войти в конфигурацию благородного газа - неона. Водород имеет один электрон в своей внешней оболочке и, получив один электрон, может достичь конфигурации благородного газа гелия. Таким образом, один атом кислорода делится двумя электронами, а два атома водорода - одним электроном, образуя одну молекулу воды, т.е. H2O.
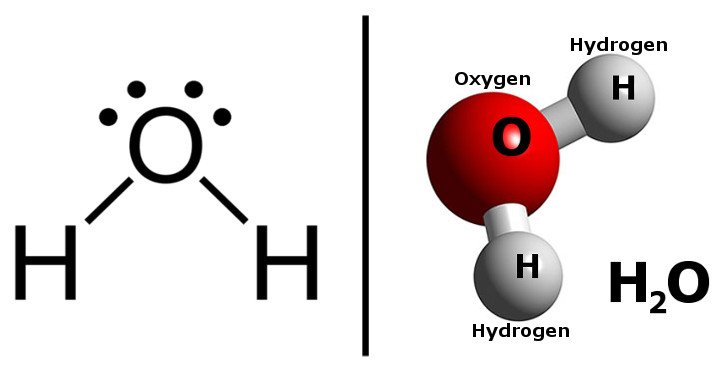
Кислород имеет высокую склонность притягивать к себе электроны. Это свойство называется электроотрицательностью. Из-за высокой электроотрицательности электроны проводят больше времени вблизи O, и на O образуется частичный отрицательный заряд. Аналогично, на H образуется частичный положительный заряд. Геометрия молекулы воды такова, что происходит разделение положительных (вблизи двух атомов H) и отрицательных зарядов (на O).
Когда две молекулы воды находятся рядом друг с другом, частично отрицательный O одной молекулы имеет тенденцию притягивать частично положительный атом H другой молекулы, что приводит к слабой связи, называемой водородной связью. Эта связь существует между двумя разными молекулами (межмолекулярная связь). Поскольку водородная связь слабая, для ее разрыва требуется меньше энергии, поэтому вода остается жидкостью при комнатной температуре.
Температура и молекулярная энергия
Температура - это мера средней кинетической энергии, которой обладает молекула. Чем выше температура, тем больше средняя энергия, и тем легче молекулам преодолеть межмолекулярное притяжение и двигаться более свободно. Для того чтобы жидкость перешла в парообразное состояние, необходимо преодолеть две силы.
Первая - это межмолекулярное притяжение близлежащих молекул, называемое когезионными силами. Вторая - нисходящее давление, оказываемое атмосферой. Когда жидкость меняет фазу на пар, ее молекулы приобретают достаточную кинетическую энергию, чтобы преодолеть все межмолекулярные силы, а также преодолеть нисходящее давление, оказываемое окружающей атмосферой.
Влажность
Количество водяного пара, присутствующего в атмосфере, называется влажностью. При любой заданной температуре атмосфера может удерживать только фиксированное количество водяного пара. Чем выше температура, тем большее количество водяного пара присутствует в атмосфере. Концентрация водяного пара в атмосфере имеет верхний предел, за которым водяной пар не может удерживаться.
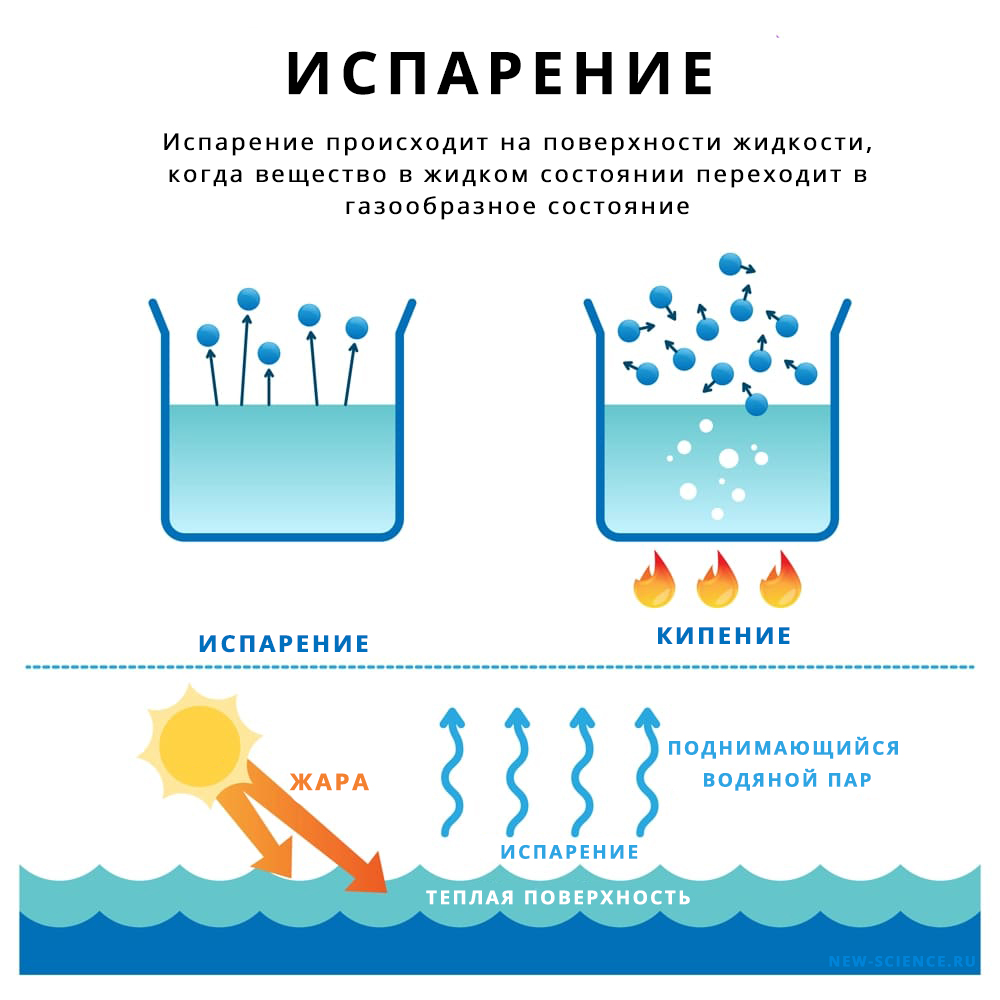
Испарение при комнатной температуре
Предположим, что вода налита на стол тонким слоем. Молекулы расположены слоями. Молекулы в самом верхнем слое испытывают межмолекулярные силы притяжения только снизу и с боков, тогда как молекулы в объеме жидкости испытывают межмолекулярное притяжение со всех сторон. Таким образом, молекулы наверху испытывают меньшие суммарные межмолекулярные силы, чем молекулы внутри объема. Поскольку эти межмолекулярные силы (водородные связи) слабы, когда верхний слой подвергается воздействию солнечного света, некоторые молекулы получают достаточно кинетической энергии, чтобы уйти в атмосферу при комнатной температуре.
Более того, чем ниже влажность, тем легче испаряется жидкость. По мере испарения концентрация водяного пара в атмосфере увеличивается. За критическим порогом атмосфера больше не может удерживать водяной пар. Это называется состоянием насыщения. Если состояние насыщения не достигнуто, испарение продолжается.
Таким образом, сочетание влажности и высокой молекулярной энергии делает возможным испарение некоторых молекул на поверхности даже при низких температурах!