Открытие ключевого "переключателя", не позволяющего иммунной системе атаковать здоровые клетки
Исследователи обнаружили белковый комплекс, который действует как "переключатель" для активации и деактивации циклического фермента GMP-AMP-синтазы - дозорного, который обнаруживает патогенную ДНК и запускает иммунный ответ. Регулирование этого пути необходимо для того, чтобы иммунная система не атаковала собственные клетки организма. Таргетинг этого комплекса может как проложить путь к новым стратегиям борьбы с аутоиммунными заболеваниями, так и помочь повысить эффективность иммунотерапии рака.
Проникновение инородного тела в наш организм запускает сложный каскад реакций, управляемых иммунной системой. Одним из основных компонентов этого каскада является циклический фермент GMP-AMP-синтаза (cGAS), который действует как дозорный, обнаруживая ДНК патогенов или дефектных клеток (в случае рака). Во время митоза, когда ядерная оболочка распадается, cGAS быстро перемещается внутрь ядра и связывается с нуклеосомами.
После связывания с нуклеосомой фермент обычно инактивируется в отсутствие чужеродной (или аберрантной) ДНК. Это состояние достигается за счет плотного связывания в определенном участке хроматина. С другой стороны, нуклеосома имеет дополнительную защиту благодаря присутствию архитектурного белка BAF, который защищает двухцепочечную ДНК от активного связывания с cGAS. Связывание с нуклеосомой и конкуренция с архитектурными белками хроматина вместе предотвращают активацию cGAS геномной ДНК хозяина.
Весь этот процесс должен быть тонко отрегулирован, чтобы не вызвать аутоиммунный ответ, характерный для воспалительных заболеваний, которыми страдает около 10 % населения Земли. "Он представляет собой сложный баланс между иммунной подготовкой и защитой целостности клеточного генома", — объясняют исследователи из Федеральной политехнической школы Лозанны (EPFL) в Швейцарии в своем пресс-релизе.
Однако то, как клетки координируют присутствие cGAS на уровне хроматина и вызываемые им реакции, во многом остается непонятным. "Вопрос в том, как клетка координирует это с другими своими повседневными функциями", — говорят специалисты EPFL, которые изучили этот вопрос в новом исследовании, недавно опубликованном в журнале .
Перспективная мишень для лечения аутоиммунных заболеваний
Чтобы изучить, как cGAS взаимодействует с нуклеосомой, исследователи использовали передовые методы молекулярной визуализации на живых клетках. Взаимодействие между ферментом и различными белковыми комплексами наблюдалось на атомном уровне с помощью структурной биологии, биохимии и клеточной биологии.
В соответствии с предыдущими наблюдениями, во время митоза фермент быстро мигрирует в ядро и связывается с нуклеосомой. Затем уровень ядерного cGAS постепенно снижался по мере продолжения цикла клеточного деления. В то же время цитозольный уровень фермента повышался.
Связывание cGAS с нуклеосомой опосредовано белковым комплексом CRL5-SPSB3, активация которого запускает разрушение ядра в присутствии патогенной или аберрантной ДНК. Более конкретно, CRL5-SPSB3 добавляет убиквитин (другой белок) к cGAS, чтобы активировать сигнальный путь интерферона 1-го типа (IFN1), который необходим для разрушения токсичных белковых комплексов. "Вмешательство в деградацию ядерного cGAS, регулируемую SPSB3, подготавливает клетки к сигналу интерферона I типа, обеспечивая повышенную защиту от инфекции ДНК-вирусами", — пишут эксперты в своем исследовании.
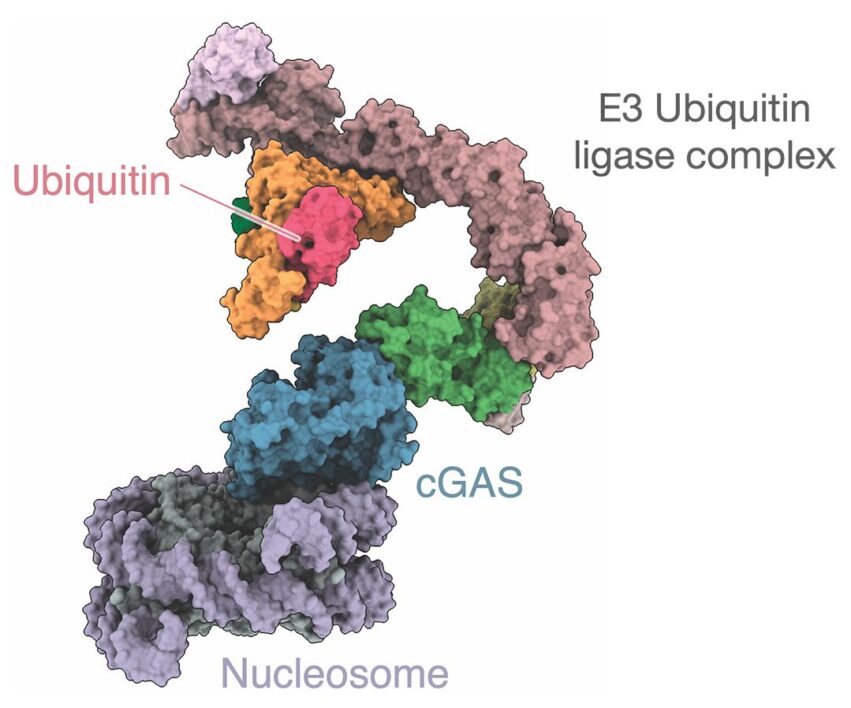
С другой стороны, убиквитинирование cGAS также вызывает его постепенную деактивацию, поскольку токсичные белковые комплексы разрушаются. Кроме того, CRL5-SPSB3 быстро деактивирует фермент, когда клетки здоровы. Это означает, что данный комплекс действует как переключатель, активируя или деактивируя cGAS в зависимости от потребностей клетки.
Эти результаты позволяют предположить, что данный белковый комплекс может стать перспективной терапевтической мишенью для борьбы с аутоиммунными заболеваниями, раком и хроническими инфекциями. Эти заболевания характеризуются, в частности, либо обостренным иммунным ответом, либо недостаточно активной иммунной системой. Однако необходимы дополнительные исследования, чтобы определить, как именно можно целенаправленно и эффективно контролировать этот путь.