Может ли сахар растопить снег, как соль? Какие другие вещества могут?

Соль растапливает снег, понижая температуру его замерзания. Сахар можно использовать для той же цели, но есть некоторые оговорки относительно этой альтернативной стратегии.
Катание на санках, лепка снеговиков и бои снежками - идеальные способы насладиться зимней погодой. Однако вы можете почувствовать себя по-другому, когда снег покрывает ваш подъезд, дороги и крыши. Уборка снега отнимает много времени и сил!
Соль может помочь нам решить эти проблемы.
Каменная соль, также известная как хлорид натрия или поваренная соль, и другие безводные соли, такие как хлорид магния и хлорид кальция, используются правительством в больших количествах для растапливания снега на дорогах в зимний период. Соли, используемые для растапливания снега на тротуарах, обычно называют дорожная соль. Ее нельзя употреблять в пищу, как пищевую соль.
Как соль растапливает снег?
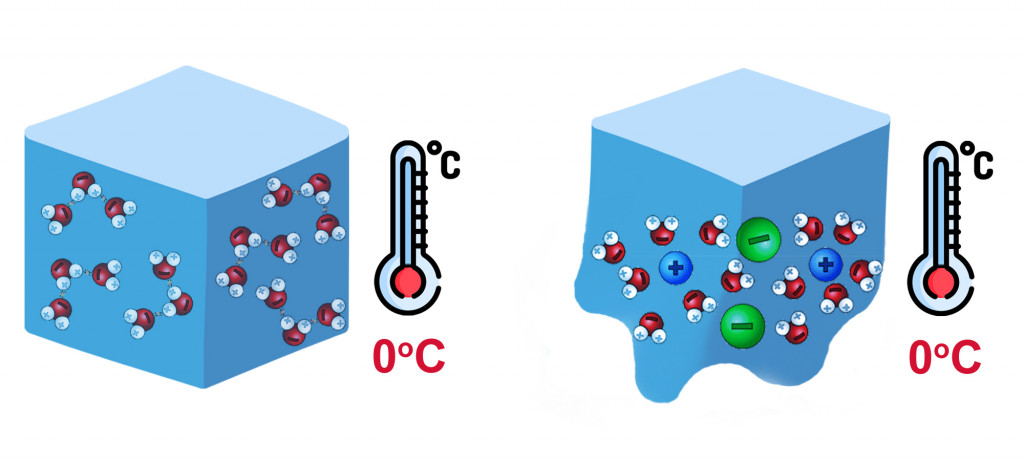
Вода замерзает при температуре 0 °C, и при этой температуре лед и вода, т.е. твердое и жидкое состояния, находятся в равновесии друг с другом. Когда мы добавляем соль (любую соль) в воду, она растворяется в ней и вызывает явление, называемое "понижением точки замерзания".
Это коллигативное свойство, проявляемое такими растворителями, как вода. Следовательно, вода, которая должна была замерзнуть при температуре 0 °C, теперь замерзнет при более низкой температуре (скажем, -10 °C), в зависимости от концентрации соли. Таким образом, если температура атмосферы составляет 0 °C, снег будет таять, а не оставаться в твердой форме.
Снег во время зимних бурь не является на 100% твердым. Он мягкий на ощупь, что свидетельствует о том, что вода не полностью замерзла. Антиобледенители растворяются в этих небольших водяных полостях и растапливают снег. Небольшой концентрации соли достаточно, чтобы растопить большой кусок снега. Дорожная соль является основным коммерческим продуктом в странах с ежегодными снежными зимами.
Может ли сахар растопить снег?
При температуре замерзания воды молекулы воды теряют свою кинетическую энергию и застывают, образуя кристаллическую структуру. По мере притяжения все большего количества молекул они становятся компактными и развивают сильное притяжение за счет водородной связи. Как видно на рисунке, при переходе воды из жидкого состояния в ледяное происходит относительное уменьшение межмолекулярного расстояния.
Это межмолекулярное расстояние нарушается, когда мы добавляем какие-либо растворимые вещества, например, соли. Молекулы, растворяющиеся в воде, преодолевают притяжение между молекулами воды и оказываются зажатыми между ними. В результате притяжение между подобными молекулами уменьшается, и для застывания требуется еще более низкая температура.
Сахар, то есть сахароза, легко растворяется в воде, поэтому он также может вызвать понижение точки замерзания воды. Однако сахароза не диссоциирует на составляющие ее ионы, а остается в виде незаряженного дисахарида. С другой стороны, соли ионизируются на составляющие их ионы, например, MgCl2 -> Mg2+ + 2Cl–, и легко вытесняют себя между молекулами воды.
Понижение точки замерзания зависит от количества растворителей, присутствующих в растворителе: чем больше частиц растворителя, тем больше понижается точка замерзания.
Поэтому, хотя сахар может растопить снег, он не может сделать это так же эффективно, как соли.
Почему мы ищем альтернативы?
После того как снег растает, он убирается либо постоянным потоком машин, либо потоком воды в ближайшую дренажную систему. Однако проблема заключается в том, что соль на дорогах может негативно влиять на окружающую среду.
Большинство дорожных солей - это соли на основе хлоридов. Хлорид - это заклятый враг для автомобилей, поскольку он инициирует разрушение под воздействием коррозии. Хлорид поглощает влагу, тем самым ускоряя скорость коррозии.
Соли, которые остаются в воде, попадают в близлежащие водоемы и могут нарушить водные экосистемы. Водоемы вблизи городов обычно представляют собой пресноводные ресурсы, такие как реки, озера и пруды; если соли попадают в эти водоемы, они снижают содержание растворенного кислорода (DO) и создают угрозу для водной жизни. Повышенная соленость приводит к токсичному цветению водорослей, убивая зоопланктон, питающийся водорослями.
Можно подумать, что соли находятся повсюду в окружающей среде, особенно хлористые соли, которые необходимы для живых клеток. Да, это так, но для того, чтобы дать вам некоторую перспективу, эти соли используются миллионами тонн каждый год. Следовательно, количество соли, попадающей в окружающую среду без очистки, превышает допустимые уровни. Поэтому нам необходимо искать альтернативные виды соли или системы снеготаяния, которые наносят меньший вред окружающей среде.
Каковы другие альтернативы?
Обычно используются следующие альтернативы хлориду:
- Свекольный сахар
- Гликоли
- Патока
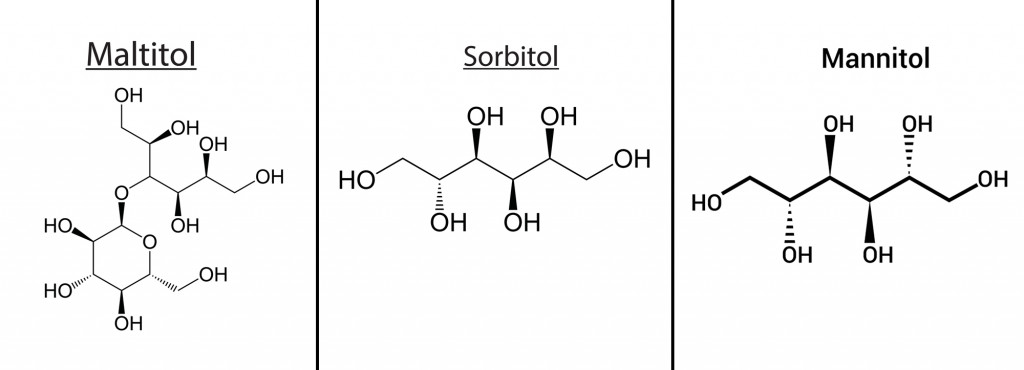
- Полиолы, полученные из кукурузы, такие как маннит, сорбит, мальтит.
- Гидравлические, электрические и инфракрасные лампы.
Наша соль встречается в природе, в то время как другие хлористые соли можно легко извлечь из минералов. Поэтому, чтобы минимизировать влияние этих солей, вместо массового производства новых солей добавляют присадки.
Эти добавки имеют биологическую основу, поэтому они легко разлагаются в окружающей среде. Было доказано, что свекольный сахар, гликоли и патока обладают хорошими противообледенительными свойствами. Добавки на основе сельскохозяйственной продукции, особенно полиолы, получаемые из кукурузы, такие как маннит, сорбит и мальтит, оказались подходящими добавками к соли, которые обеспечивают хорошее понижение точки замерзания воды.
Помимо химикатов, снег можно растопить с помощью машин. Распыление пара и горячей воды на скопившийся снег оказывается эффективным и устраняет необходимость ручной уборки снега. Гидронические, электрические и инфракрасные лампы делают то же самое с поверхностями тротуаров, тротуаров и настилов мостов.
Поиск альтернатив хлористым солям не дает покоя исследователям, в основном по двум причинам: стоимость и энергия. Вышеупомянутые добавки дорого стоят для производства в таких больших количествах, а машины являются энергоемкими инструментами. Таким образом, поиск идеальной альтернативы, которая удовлетворяла бы всем требованиям, является постоянной задачей.
Снег растапливают, манипулируя понижением точки замерзания, часто с помощью растворимых растворителей, таких как соли и сахара. Концентрация и температура атмосферы также играют существенную роль в эффективности этих антиобледенителей. Промышленный антиобледенитель на основе NaCl не может растопить лед при температуре ниже -100 °C. Поэтому для растапливания снега при экстремальных температурах добавляются различные соли и добавки, которые оказывают менее вредное воздействие на окружающую среду.