Метод редактирования генов деактивирует ВИЧ в лабораторных условиях: есть ли надежда на его искоренение?
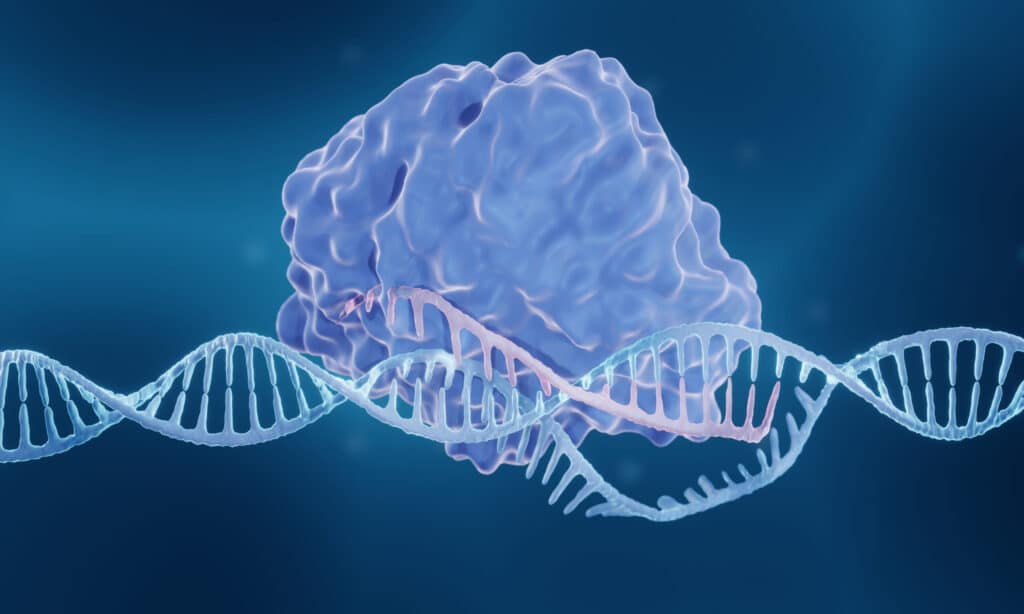
Исследователи предположили, что метод редактирования генов CRISPR-Cas может быть использован для деактивации ВИЧ в инфицированных клетках. В экспериментах in vitro методика смогла деактивировать патогенные геномы нескольких разновидностей вируса. Несмотря на то, что для клинического применения этой технологии необходимо провести дополнительные исследования, полученные результаты достаточно многообещающи, чтобы в перспективе привести к излечению от СПИДа.
СПИД является серьезным бременем для общественного здравоохранения, от него страдают около 39 миллионов человек во всем мире. Пока не существует ни вакцины, ни реального лекарства от этого заболевания. Современное медицинское лечение обычно состоит из комбинированной антиретровирусной терапии (cART), которая не уничтожает вирус, а лишь контролирует его репликацию.
Однако этот вид лечения имеет ряд недостатков. Не все инфицированные пациенты имеют к нему доступ, а те, кто имеет, должны принимать его на протяжении всей жизни, чтобы контролировать вирусную нагрузку. Кроме того, заболевание характеризуется наличием долгоживущих вирусных резервуаров, механизмы и точное местоположение которых до конца не изучены. Это клетки, которые изначально были заражены вирусами, способными к репликации, но которые стабилизировались и превратились в латентные вирусные резервуары. Эти резервуары могут в любой момент активизироваться и возобновить вирусную репликацию, если прекратить антиретровирусное лечение.
Поэтому современные исследования в области борьбы с этим заболеванием направлены на уничтожение вируса и его вирусных резервуаров. Недавно было высказано предположение, что метод редактирования генов CRISPR-Cas может быть использован для непосредственного воздействия на вирусные геномы. Фактически, изменяя целевую генетическую последовательность, можно использовать этот метод как форму генной терапии для лечения ряда заболеваний. В прошлом году подобная терапия была одобрена в США и Великобритании для лечения серповидно-клеточной анемии.
Исследователи из Амстердамского университета доказали жизнеспособность этой концепции в отношении ВИЧ в ходе недавних лабораторных экспериментов. "Мы разработали комбинаторную CRISPR-атаку, которая эффективна против ВИЧ в различных клетках и местах, где он может скрываться в резервуарах, и продемонстрировали, что лечение может быть доставлено именно в интересующие клетки", — объясняют они в пресс-релизе Европейского общества клинической микробиологии и инфекционных заболеваний. Результаты исследования будут представлены на Европейском конгрессе по клинической микробиологии и инфекционным заболеваниям (ECCMID 2024), который пройдет с 27 по 30 апреля в Барселоне.
Терапия, направленная на несколько вариантов вирусов
Система CRISPR-Cas была впервые обнаружена у прокариотических бактерий, которые используют ее в качестве механизма иммунного ответа против бактериофагов и вторгающихся плазмид. Она функционирует как молекулярные "ножницы", позволяя разрезать и изменять целевую генетическую цепь под руководством направляющих РНК (gRNAs). Термин Cas обозначает нуклеазу, которая связывается с короткой CRISPR РНК (crRNA), нацеливаясь на соответствующие последовательности вирусной ДНК или РНК. Эндонуклеазы Cas9 и Cas12 расщепляют ДНК, а Cas13 - РНК.
В новом исследовании голландские ученые использовали этот метод на консервативных последовательностях ВИЧ, то есть последовательностях, общих для всех вирусных штаммов. Такая стратегия позволит создать терапию широкого спектра действия, которая будет направлена сразу на несколько вариантов вируса. "Наша цель — разработать надежную и безопасную комбинаторную схему CRISPR-Cas, стремясь к созданию инклюзивного лекарства от ВИЧ, способного инактивировать различные штаммы ВИЧ в различных клеточных контекстах", — пояснили они.
Однако вирусный вектор, необходимый для проведения терапии, был слишком велик, чтобы проникнуть в инфицированные клетки должным образом. Тогда исследователи разработали методику уплотнения груза, чтобы его можно было вводить с помощью векторов меньшего размера. С другой стороны, нацеливание на клетки-резервуары также представляет собой серьезную проблему. Чтобы решить эту проблему, специалисты определили белки, специфичные для этих клеток, на которые может быть направлена терапия.
Затем, чтобы оценить эффективность терапии, они провели испытания на ВИЧ-инфицированных бактериях. Методика продемонстрировала исключительную эффективность, полностью инактивируя вирус с помощью одной гРНК и удаляя вирусную ДНК с помощью двух гРНК. Аналогичная эффективность наблюдалась и в отношении клеток-резервуаров.
Однако, хотя результаты выглядят многообещающе, на данный момент это лишь доказательство концепции, говорят эксперты. Для того чтобы действительно оценить эффективность терапии, необходимо провести дополнительные исследования. Следующим шагом станет оптимизация ее применения таким образом, чтобы воздействовать на большинство резервуарных клеток. Затем стратегия будет протестирована на доклинических моделях, чтобы оценить реакцию на уровне целых живых организмов. Этот шаг необходим для того, чтобы определить, как добиться специфического ответа и избежать воздействия на клетки, не являющиеся резервуарами.
"Мы надеемся достичь правильного баланса между эффективностью и безопасностью с помощью этой стратегии. Только тогда мы сможем планировать клинические испытания на людях для деактивации резервуаров ВИЧ", — заключили они.