
От эпохи древнегреческой философии до современной квантовой механики атомная теория получала множество обновлений, и каждое из них было весьма революционным для своего времени.
Наше понимание природы окружающих нас вещей продолжает меняться с течением времени. То, что кажется нам очевидным сейчас, могло бы не существовать столетие назад или устареть в ближайшие десятилетия. Прекрасным примером того, как наука совершенствуется с течением времени, является эволюция атомной теории.
Давайте начнем со старых добрых времен, когда наука была не доказательной базой, а философией, и люди верили, что все состоит только из четырех элементов. Представьте себе, насколько простой была бы химия в те времена.
Демокрит

Около 400 года до н.э. греческий философ по имени Демокрит выдвинул теорию о том, что все в мире состоит из крошечных неразрушимых частиц, называемых "атомос", что означает "неделимый". Он считал, что свойства материалов зависят от типа атомоса, из которого они состоят. Например, кислые или острые на вкус вещи состояли из частиц с заостренными краями, сладкие - из более округлых гладких атомов, а металлы - из твердых атомов. За исключением этого неправильного толкования формы, он был практически на верном пути в том, что атомный состав диктует свойства вещества.
Но эта теория была в значительной степени дискредитирована Аристотелем, который считал, что все на нашей планете состоит из четырех элементов: земли, огня, воды и воздуха.
Джон Дальтон

Следующая остановка в атомной теории произошла спустя почти 2000 лет, от британского химика и любителя метеорологии Джона Дальтона. Он проводил эксперименты, в которых смешивал два газа и наблюдал за их поведением. Большинство газов, которые он тестировал, существовали независимо, не беспокоясь о присутствии другого. Но он обнаружил нечто иное, когда оксиду азота позволили взаимодействовать с атмосферным кислородом. 36 мер чистого азотистого газа прореагировали со 100 мерами воздуха и дали 80 мер нового газа, который не был ни азотистым, ни кислородным.
Это вызвало у него любопытство, поэтому он провел один и тот же эксперимент с разными объемами газа. Он заметил, что газы реагируют друг с другом только в фиксированном соотношении. Это породило закон кратных отношений и теорию атомизма.
Дальтон предположил, что все в этом мире состоит из атомов - крошечных неразрушимых твердых сфер, которые уникальны для каждого элемента. Атомы различных элементов соединяются, образуя различные соединения, и перестраиваются в ходе химической реакции. Даже спустя 200 лет кое-что из этого остается правдой.
Джозеф Джон Томсон

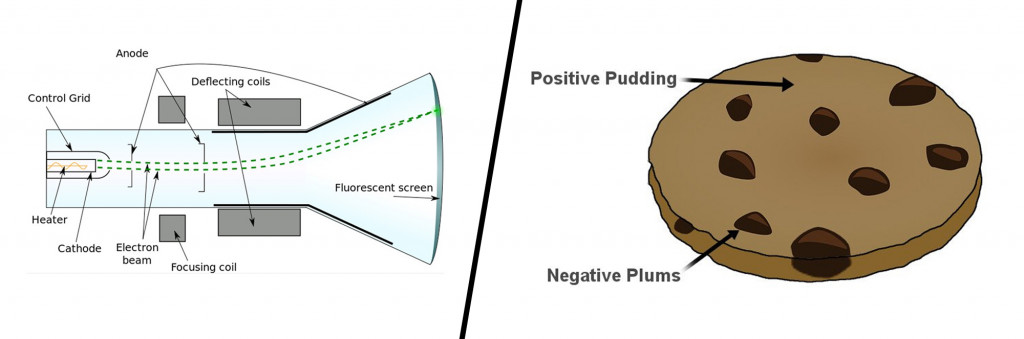
До конца 19 века атомы представлялись неделимыми частицами, но первым, кто разрушил это представление, был английский физик Джозеф Джон Томсон и его надежная катодно-лучевая трубка. Внутри почти вакуумной стеклянной трубки видимый пучок частиц или катодных лучей генерировался путем приложения высокого напряжения к металлическим электродам. Поток частиц, образовавшихся из металла, отклонялся от отрицательного заряда в сторону положительного заряда.
Повторив этот эксперимент несколько раз с другими металлами, он придумал первую атомную модель. Его знаменитая модель сливового пудинга описывала атом как частицу, состоящую из положительно заряженной массы (пудинг) с крошечными отрицательными зарядами, встроенными в нее (как сливы).
Эрнест Резерфорд

После некоторого первоначального сопротивления эта модель стала довольно популярной в научном мире. Тем не менее уроженец Новой Зеландии Эрнест Резерфорд не был в этом уверен. В начале 1900-х годов радиоактивность была в моде, и Резерфорд во время своей работы по радиоактивному распаду открыл альфа, бета и гамма-лучи. Он хотел разработать метод альфа-частиц и использовать его для исследования структуры атома.
Он сделал то, что делал каждый физик в то время, он поставил эксперимент. Эксперимент с золотой фольгой, также известный как эксперименты Гейгера-Марсдена, состоял из тонкой золотой фольги с круглым экраном, покрытым сульфидом цинка за ней, который вспыхивал каждый раз, когда в нее попадала альфа-частица. Резерфорд ожидал, что частицы вылетают из фольги и ударяются об экран позади нее. Хотя большинство частиц действительно вели себя так, как ожидалось, некоторые из них отклонились на угол более 90 градусов.
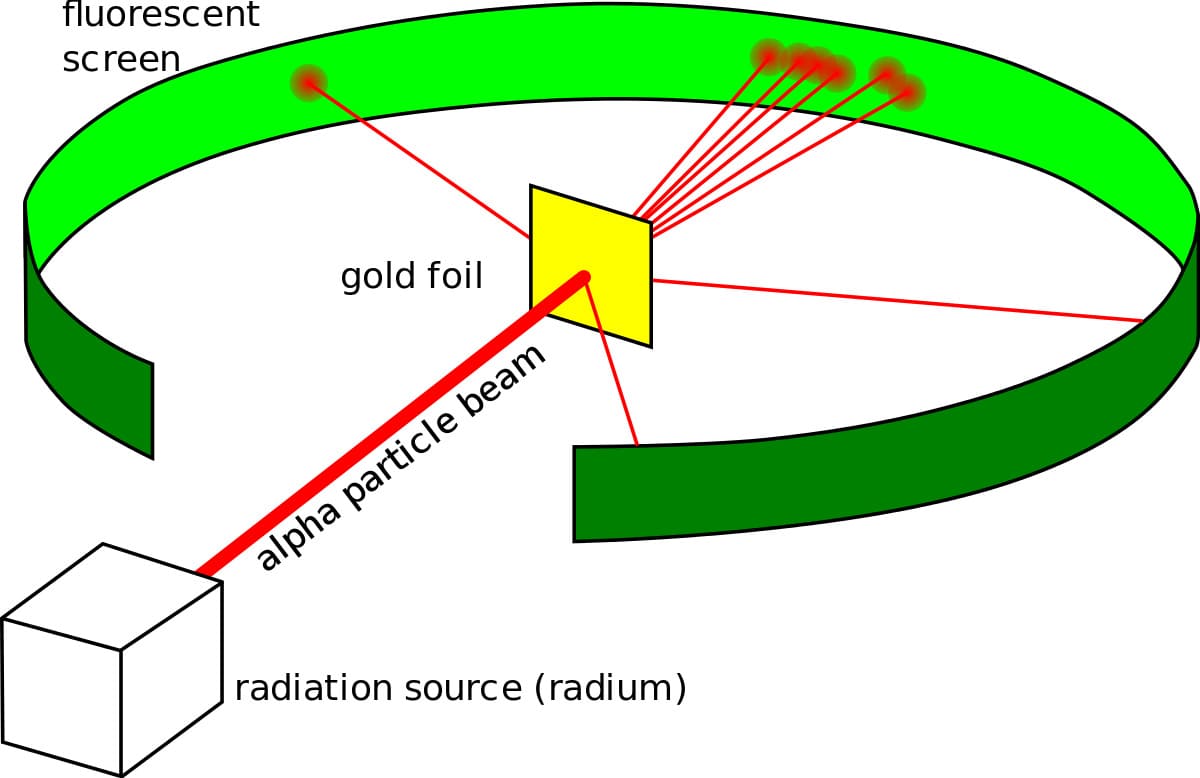
Опираясь на свои наблюдения, он предложил новую модель атома, опровергающую предыдущую. Он предложил атомную структуру, в которой большая часть массы атома сосредоточена в положительно заряженном центре (который он позже назвал ядром - латинское слово "орех"), вокруг которого электроны вращаются, как планеты вокруг Солнца.
Нильс Бор

Через год после публикации атомной теории Резерфорда Нильс Бор обнаружил несоответствие в этой модели. Если бы электроны вращались вокруг положительно заряженного центра, то в какой-то момент эти электроны потеряли бы свою энергию и упали на ядро, сделав атомы нестабильными. Но этого не происходило, атомы были довольно стабильны (кроме радиоактивных).
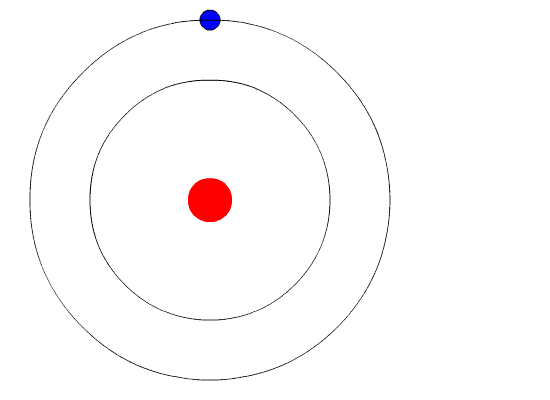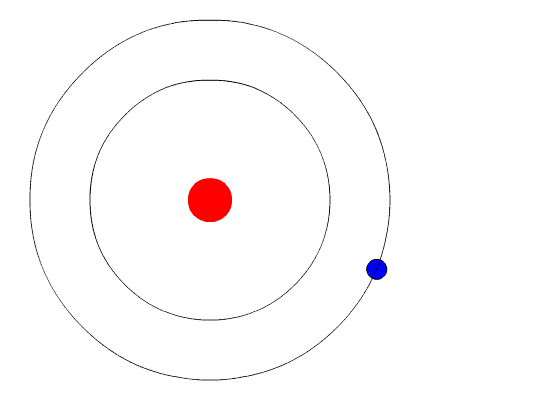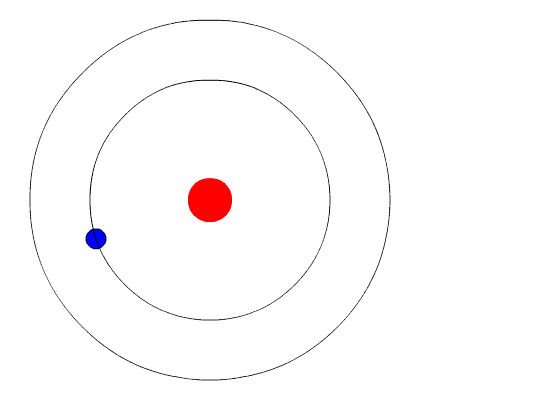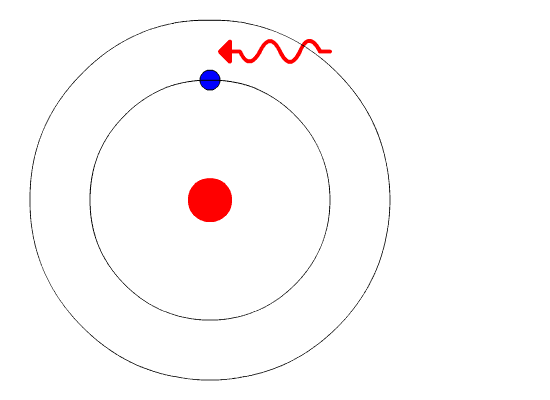
Вот тут-то и пришла на помощь квантовая физика. Он использовал концепцию квантованной энергии, чтобы предположить, что электроны движутся вокруг ядра по фиксированным орбитам или оболочкам. Оболочка, расположенная ближе к ядру, имеет более низкую энергию, а самая дальняя - самую высокую. Если электрон переходит на орбиту с более низкой энергией, он отдает дополнительную энергию в виде излучения. Тем самым поддерживается атомная стабильность.
Несмотря на то, что модель Бора не соответствует действительности для сложных многоэлектронных систем, она по-прежнему является наиболее популярным представлением атомной структуры в большинстве учебников.
Атомная модель Шредингера

Как бы мы ни старались, сложностей квантовой механики не избежать. С установлением квантового поведения таких сущностей, как электрон, стало совершенно ясно, что атомная модель Бора не удовлетворяет принципу неопределенности Гейзенберга. Согласно принципу неопределенности, невозможно узнать точное положение и траекторию движения электронов в атоме, а значит, они не могут существовать на фиксированных орбитах, как предполагал Бор.
Объединив концепцию двойственности волна-частица и принцип неопределенности, Эрвин Шредингер придумал квантово-механическую модель атома. В этой модели электроны вращались вокруг ядра не по круговым орбитам, а в виде электронных облаков на атомной орбитали, которая представляет собой область внутри атома, где вероятность нахождения электрона наиболее высока. Он также сформулировал волновые уравнения Шредингера, которые помогут нам точно рассчитать энергию уровней электронов в атоме. Эта новая и усовершенствованная атомная модель не говорит нам, где находится электрон, но где он может находиться.
Человечество всегда мучилось вопросами: Из чего состоят окружающие нас вещи? И почему они ведут себя по-разному?
И каждый шаг в развитии атомной теории приближал нас к пониманию секретов субатомных частиц, управляющих нашим живым и ярким миром.