Из чего образуются пузыри при закипании воды?

Если вы когда-нибудь кипятили воду, то наверняка заметили, что при нагревании воды образуются очень маленькие пузырьки, которые поднимаются снизу вверх. Сначала пузырьки немногочисленны, но по мере нагревания воды начинает образовываться все больше пузырьков больших размеров. Дальнейшее повышение температуры приводит к появлению еще более крупных пузырьков, которые образуются довольно часто и сразу же поднимаются вверх. Эта эскалация достигает пика, когда вода начинает кипеть.
Но почему кипящая вода образует пузырьки?
Ответ на этот вопрос связан с химией самой воды. Точнее, это связано со всеми растворенными в воде веществами, а также с характером связи между молекулами воды.
Химические свойства молекул воды
Каждая молекула воды состоит из двух атомов водорода (H) и одного атома кислорода (O). Оба атома H ковалентно связаны с единственным атомом O. Каждый элемент в природе стремится достичь состояния с минимально возможной энергией. Это состояние достигается путем потери или приобретения электронов для достижения ближайшей конфигурации инертного газа.
Атом кислорода имеет шесть электронов в своей валентной (внешней) оболочке. Ближайший инертный газ, неон, имеет восемь электронов в своей валентной оболочке. Таким образом, O имеет сильную тенденцию получить два электрона и достичь стабильной электронной конфигурации (перейти в состояние с наименьшей энергией). Водород имеет один электрон в своей валентной оболочке, в то время как ближайший благородный газ, гелий, имеет два электрона на своей валентной оболочке. Таким образом, H стремится получить один электрон, чтобы достичь стабильной электронной конфигурации.
Оба атома H делят по одному электрону с O, а O делит два электрона, по одному на каждый H. Это ковалентная связь. Кислород имеет сильную тенденцию притягивать к себе общие электроны благодаря свойству, называемому электроотрицательностью. Таким образом, электроны проводят больше времени возле атома O, чем возле атома H, что приводит к частичному отрицательному заряду на O и частичному положительному заряду на H.
Геометрия молекулы воды такова, что заряды не компенсируются, и есть разделение центров заряда (поляризация). Когда две молекулы воды с небольшой поляризацией приближаются друг к другу, частично отрицательный O одной молекулы притягивает частично положительный H другой молекулы, образуя слабую межмолекулярную связь. Это называется водородной связью, и это сила, отвечающая за удержание молекул воды вместе.
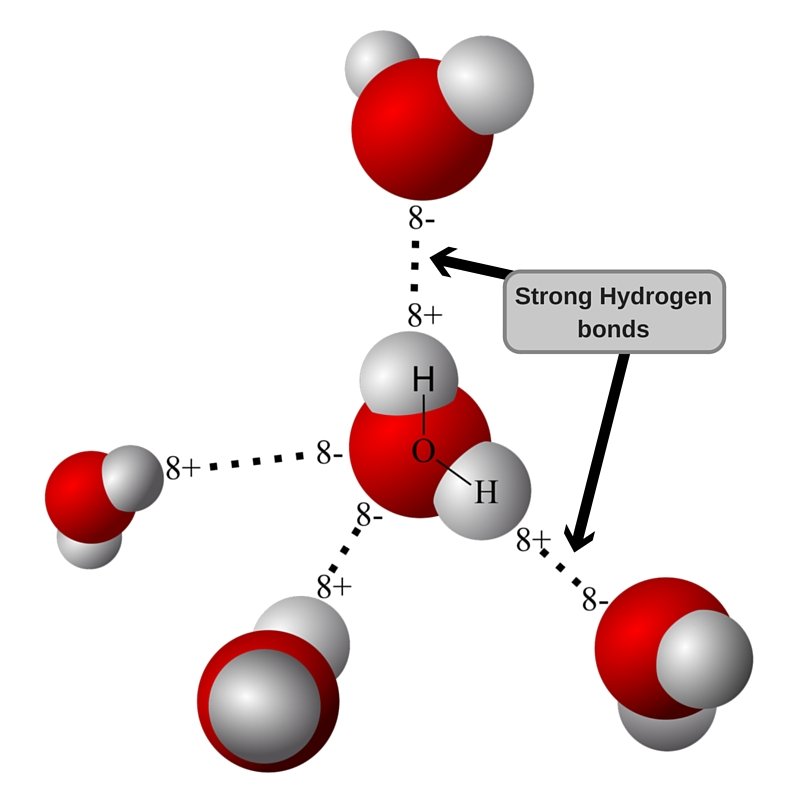
Поскольку водородная связь слабая, вода остается жидкой при комнатной температуре, а при повышении температуры молекулы получают больше энергии для преодоления межмолекулярной водородной связи. При 100 °C энергии достаточно для того, чтобы молекулы вырвались на свободу.
Растворенные вещества в воде
Растворение одного вещества в другом возможно только при наличии взаимодействия между молекулами двух веществ. Подобным образом, некоторые газы, например, O2, CO2, N2, NH3 и SO2, растворяются в воде, потому что между молекулами воды и молекулами газа существует притягательное взаимодействие.
Есть два способа растворения газов в воде: ван-дер-ваальсова связь и водородная связь.
Гетероядерные молекулы (т.е. имеющие атомы из разных элементов), такие, как NH3 или CO2, имеют разницу в электроотрицательности между атомами. N и O более электроотрицательны, чем H и C, соответственно. Таким образом, N и O остаются частично отрицательными, а H и C становятся частично положительными. Это приводит к частичной поляризации молекул NH3 и CO2.
Отрицательные концы (N и O) притягиваются к частично положительному H воды; в то же время положительные концы (H и C) притягиваются к частично отрицательному O воды. Это и есть водородная связь. Чем больше поляризация газообразной молекулы, тем лучше она растворяется в воде.
Гомоядерные молекулы (т.е. имеющие атомы одного и того же элемента), такие, как O2 и N2, неполярны и плохо растворимы (очень низкая растворимость) в воде. Слабые ван-дер-ваальсовы силы притяжения удерживают эти газы с молекулами воды. Они намного слабее, чем диполь-дипольные взаимодействия.
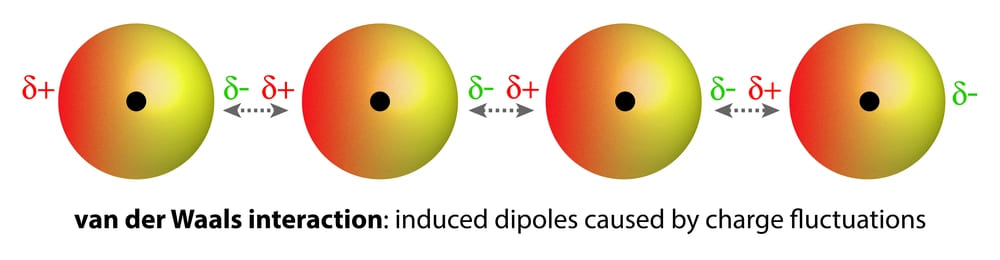
Растворимость газов в воде уменьшается при повышении температуры.
Последовательность событий при кипении воды
Возьмем жидкую воду при комнатной температуре (25 °С). При этой температуре растворимость O2 составляет 8,27 мг/л, а CO2 - 1,5 г/л. При повышении температуры молекулы газа и воды приобретают больше кинетической энергии. Благодаря этой энергии всем молекулам легче преодолеть межмолекулярное притяжение. При температуре 50 °С растворимость O2 уменьшается до 2,75 мг/л, а растворимость CO2 - до 0,75 г/л. Это снижение растворимости означает, что газообразные молекулы могут преодолеть слабое межмолекулярное притяжение. Поскольку плотность молекул газа ниже плотности воды, они поднимаются наверх в виде пузырьков. Гомоядерные молекулы, такие как N2 и O2, всплывают при низких температурах из-за слабых ван-дер-ваальсовых сил. Дальнейшее повышение температуры приводит к выделению пузырьков полярных молекул, таких как CO2 и NH3, которые удерживаются диполь-дипольными взаимодействиями.

Это бульканье продолжается до тех пор, пока не будет достигнута точка кипения воды. Нагревание воды происходит не совсем равномерно, то есть существуют области более высоких и более низких температур. При температуре выше 90 °С некоторые молекулы воды вблизи дна получают достаточно энергии для перехода в парообразную фазу. Образуются области газообразной воды, о чем свидетельствуют огромные пузыри, поднимающиеся со дна. Кроме того, из-за энергичного движения молекул конвективный нагрев еще больше повышает температуру. При температуре 100 °С почти все молекулы воды обладают достаточной кинетической энергией для перехода в парообразное состояние, и пузырьки водяного пара начинают стремительно подниматься вверх!