13 лучших примеров слабых оснований и их использование

В химии основание можно определить как вещество, которое диссоциирует в водном растворе с образованием гидроксид-ионов (ОН -). Слабое основание - это основание, которое не полностью распадается на составляющие ионы при растворении в растворе. Некоторые части слабого основания диссоциируют на ионы гидроксида, в то время как некоторые остаются недиссоциированными внутри водного раствора.
Конъюгированная кислота слабого основания всегда является слабой кислотой, а сопряженное основание слабой кислоты всегда является слабым основанием.
Как определить слабое основание?
Обычно pH слабого основания находится в диапазоне от 7 до 11. Концентрация ОН - часто используется в качестве альтернативы pH для измерения относительной концентрации H + / OH− в растворе. Более высокое содержание гидроксида означает более низкую концентрацию водорода, следовательно, более высокий pH.
Кроме того, слабые основания имеют более низкую константу диссоциации основания (K b). Она аналогична константе диссоциации кислоты и представляет собой относительную силу основания. По мере того как основания становятся слабее, их значения Kb становятся меньше.
В этой статье мы использовали значения pK b для обозначения основности соединения. Это просто отрицательный десятичный логарифм Kb раствора.
Теперь, когда у вас есть общее представление о значениях pH и K b, давайте рассмотрим некоторые из наиболее распространенных примеров слабого основания и их важность.
13. Гидроксиламин
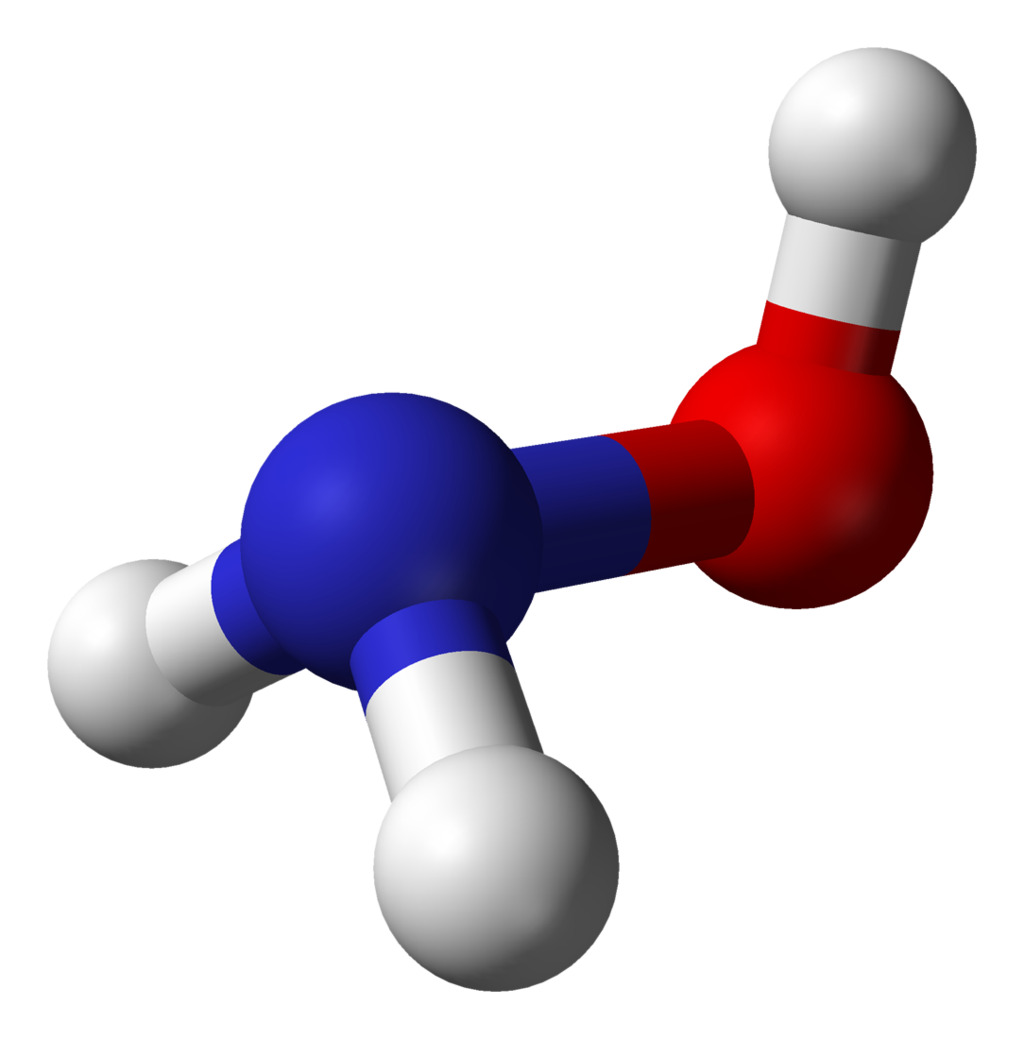
Формула: NH2OH
Основность (pK b): 8.05
Гидроксиламин - это кислородсодержащее производное аммиака. Чистый гидроксиламин представляет собой бесцветное кристаллическое твердое вещество, растворимое в воде. Его неорганические соли являются мощными восстановителями, используемыми для синтеза различных полимеров и в качестве компонентов фотопроявителей. Они также могут выступать в качестве антиоксидантов для жирных кислот.
Гидроксиламин также является промежуточным продуктом в процессе биологической нитрификации микробами, например, бактериями. В полупроводниковой промышленности он часто используется для удаления фоторезистов после литографии.
Исследователи изучают его нитратную соль под названием нитрат гидроксиламмония в качестве ракетного топлива. Результаты показывают, что его твердая форма может быть использована для изготовления твердого ракетного топлива, а водный раствор - для приготовления монопропеллента.
Поскольку гидроксиламин представляет опасность возгорания при воздействии сильного тепла, его потенциальное использование должно быть тщательно оценено. Природа взрывоопасности до сих пор недостаточно хорошо изучена.
12. Триметиламин
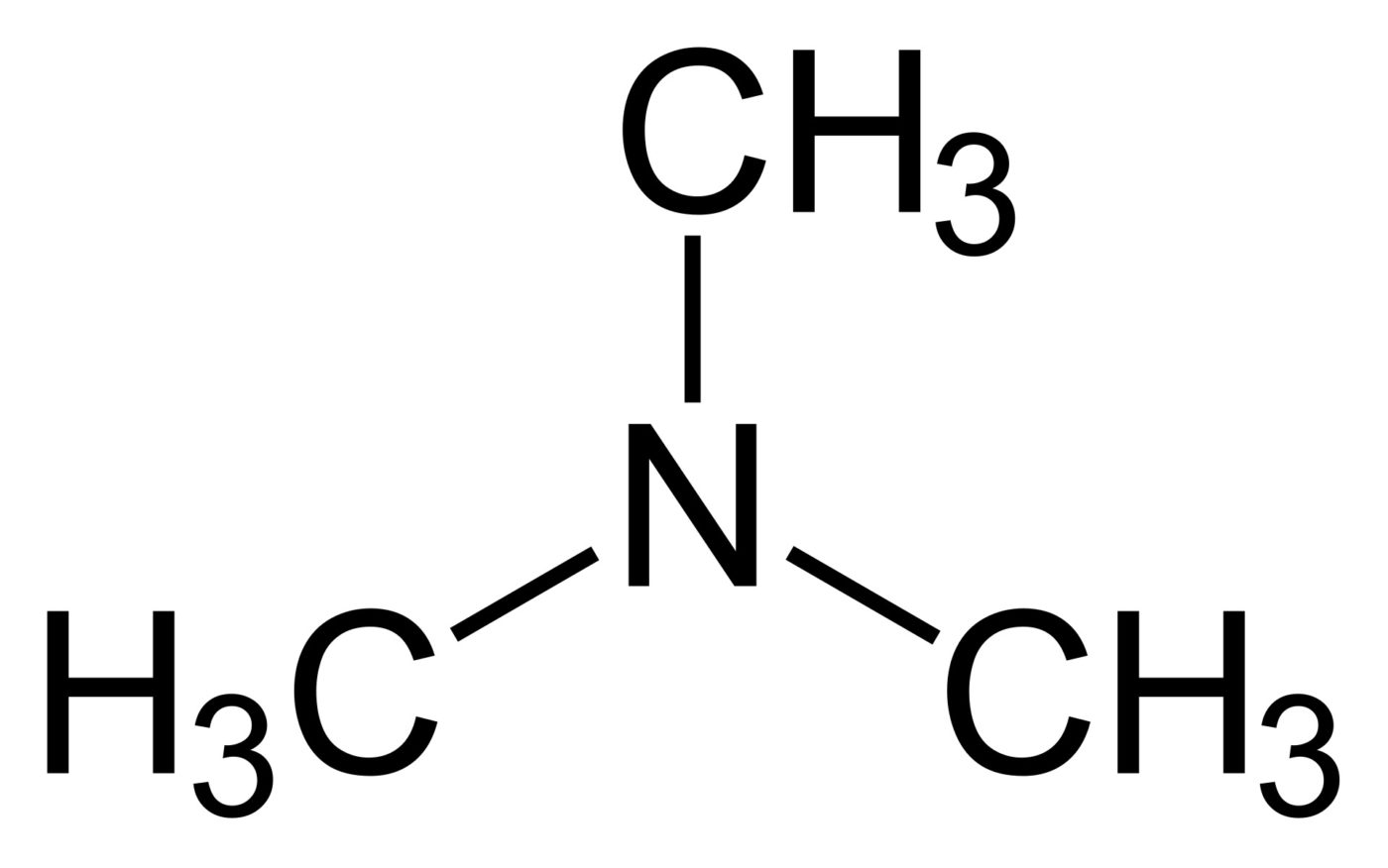
Формула: N(CH3)3
Основность (pK b): 4,20
Триметиламин - это бесцветный третичный амин, в котором каждый атом водорода замещен метильной группой. Центральный атом азота присоединен к трем метильным группам в тригонально-пирамидальной геометрии.
Триметиламин является газом при комнатной температуре, но хорошо растворяется в воде. Обычно он продается в виде 40% раствора в воде. При более низких концентрациях пахнет гниющей рыбой. При более высоких концентрациях пахнет аммиаком. Кратковременное вдыхание высоких концентраций или длительное вдыхание низких концентраций может вызвать серьезные проблемы со здоровьем.
Соединение является отличным нуклеофилом, что означает, что оно может образовывать связи с электрофилами, отдавая электронную пару. Он имеет несколько промышленных применений - в основном он используется для синтеза регуляторов роста растений, выравнивающих красителей агентов, гидроксида тетраметиламмония и холина.
11. Гидразин
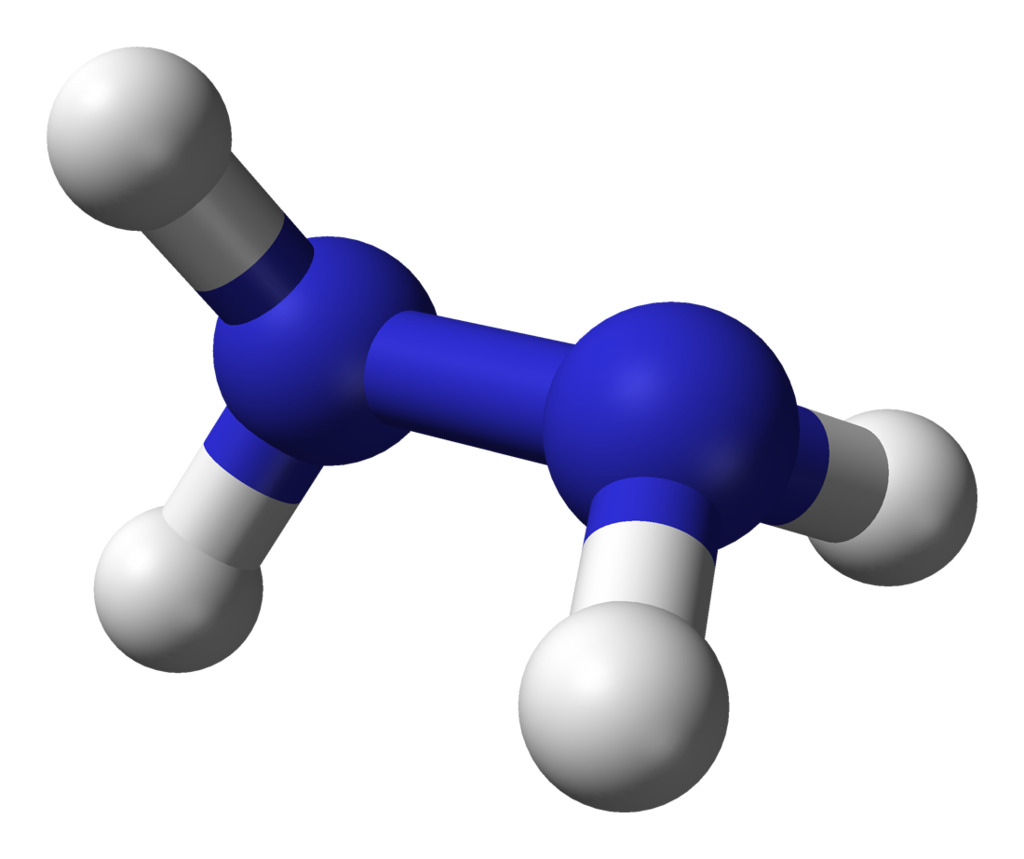
Формула: N2H4
Основность (pK b): 8.1
Гидразин представляет собой соединение, содержащее два атома азота с одинарной связью и четыре периферийных атома водорода. Его водный раствор (концентрация более 37%) бесцветен, вызывает коррозию и токсичен при проглатывании и абсорбции через кожу.
Когда гидразин смешивается с водой, он образует более плотный моногидрат (1,032 г/см3), чем безводное вещество.
N 2 H 4 + H 2 O -> [N 2 H 5] + + OH -
Как и аммиак, гидразин обладает основными (щелочными) химическими свойствами. Это высокореакционная основа и восстановитель, используемый в широком спектре медицинских и промышленных применений.
Ежегодно во всем мире производится около 100,00 метрических тонн гидразина. В основном он используется как пенообразователь для производства пенопласта.
Он также используется в качестве ракетного топлива - при сгорании топлива гидразин разлагается на газообразные аммиак, азот и водород, выделяя большое количество тепловой энергии. Газообразные водород и азот вытесняются из ракеты через сопло для создания тяги.
10. Гидроксид алюминия
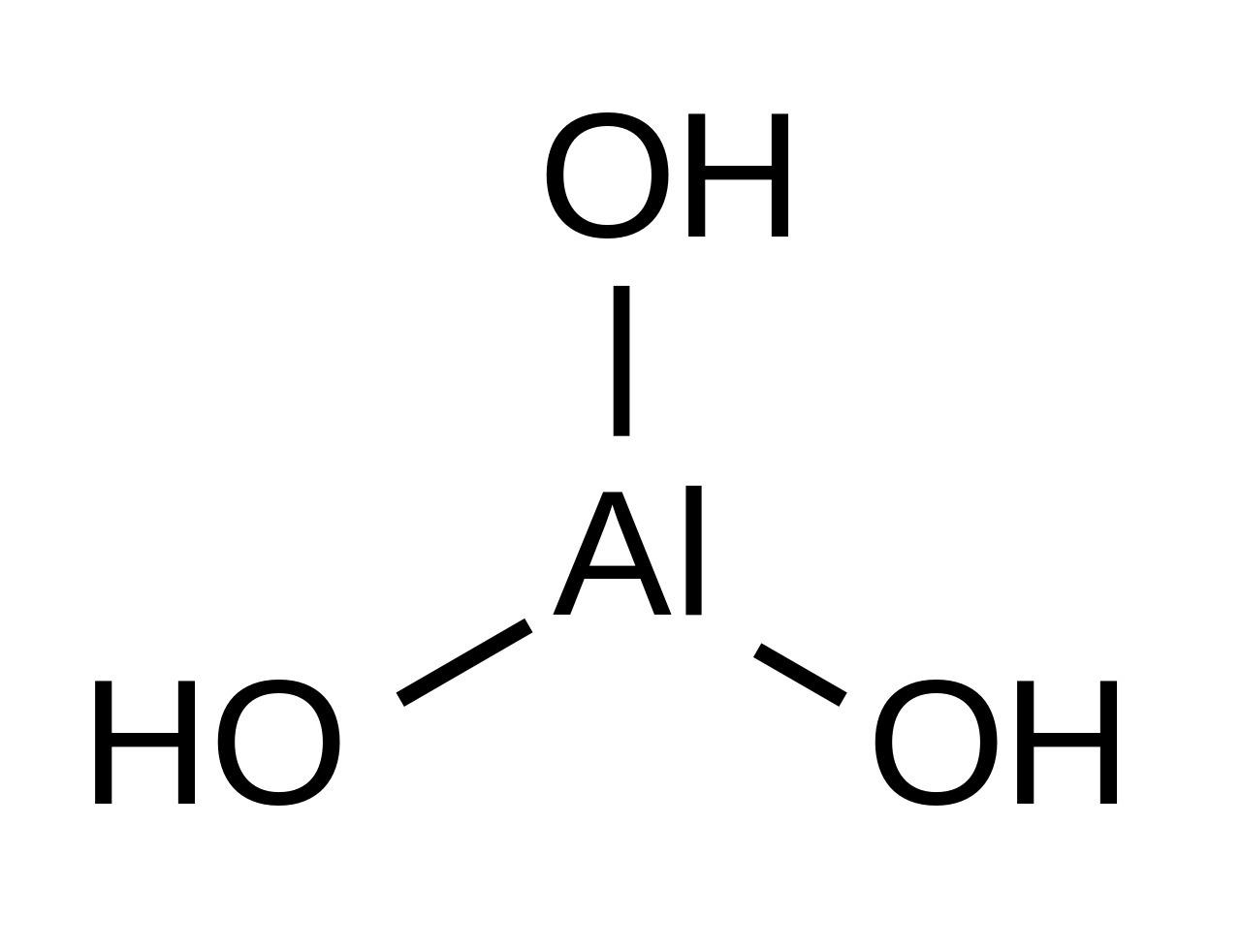
Формула: Al(OH)3
Основность (pK b): 7,5
В чистом виде гидроксид алюминия представляет собой белые гранулы или порошок плотностью около 2,4 г/мл. Хотя он не растворяется в воде, он быстро растворяется в сильных основаниях и кислотах.
Гидроксид алюминия обладает двумя уникальными свойствами:
- Амфотеризм: это означает, что он может реагировать либо как основание, либо как кислота. Например, ОН в гидроксиде алюминия может действовать как слабое основание при смешивании с сильной кислотой, такой как соляная кислота. С другой стороны, когда он реагирует с сильным основанием, таким как гидроксид натрия, ОН в гидроксиде алюминия действует как слабая кислота.
- Полиморфизм: это означает, что соединение может существовать в нескольких формах. Известно, что гидроксид алюминия имеет четыре различные формы - байерит, гиббсит, дойлеит и нордстрандит.
Гидроксид алюминия обычно используется в качестве дополнительного ингредиента в антацидных препаратах. Доказано, что он эффективен при лечении изжоги, кислотного расстройства желудка и расстройства желудка. Он также используется в обрабатывающей промышленности и в качестве огнезащитного наполнителя для полимеров.
9. Гидроксид цинка

Формула: Zn(OH)2
Основность (pK b): 8.15
Гидроксид цинка выглядит как белое твердое вещество и имеет плотность 3,05 г / см3. Он встречается в природе в трех редких минералах, а именно ашоверите, сладките и вульфингите. Его также синтезируют в лаборатории путем смешивания раствора гидроксида натрия с раствором любой соли цинка.
Подобно гидроксидам других металлов, таких как хром, олово, бериллий, свинец и алюминий, гидроксид цинка является амфотерным. Это означает, что он может реагировать и как кислота, и как основание. Он легко растворяется в растворе сильного основания (например, гидроксида натрия), а также в растворе сильной кислоты (например, соляной кислоты).
Гидроксид цинка в основном используется в качестве абсорбирующего агента в хирургических повязках. Он также используется в качестве промежуточного продукта при производстве пестицидов и пигментов.
8. Гидрокарбонат натрия

Формула: NaHCO3
Основность (pKb): 3.67
Гидрокарбонат натрия представляет собой белые твердые кристаллы, которые часто выглядят как мелкий порошок. Он имеет щелочной вкус, который похож на вкус карбоната натрия (стиральной соды). Его природная минеральная форма - нахколит, который встречается в ассоциации с галитом, буркитом, бурой, тоардитом и термонатритом.
NaHCO3 + H2O –> Na+ + H2CO3 + OH–
Соединение гидролизуется в воде с образованием катиона натрия и гидроксид-иона. Присутствие гидроксид-ионов делает соединение слегка основным.
Он в основном используется в выпечке как разрыхлитель. При смешивании с водой он действует как антацид, который довольно эффективен при лечении кислотного расстройства желудка и изжоги.
Бикарбонат натрия быстро реагирует с кислотами, образуя углекислый газ. Вот почему он широко используется для нейтрализации разливов кислоты и нежелательных кислотных растворов в химических лабораториях.
7. Пиридин
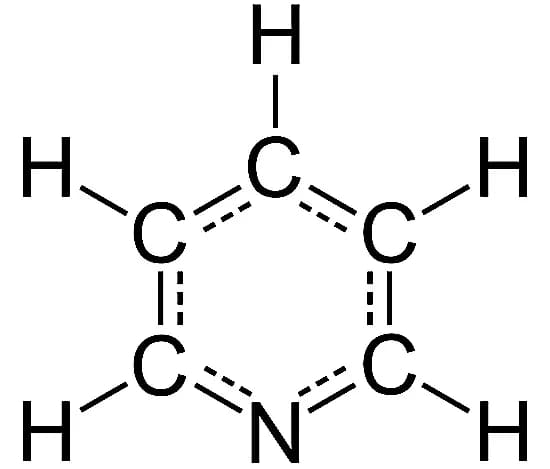
Формула: C5H5N
Основность (pKb): 8,75
Структура пиридина очень похожа на структуру бензола, но одна метиновая группа заменена атомом азота. Наличие азота (и его одинокой пары) в бензольном кольце делает пиридин уникальным соединением в химии.
Пиридин является значительно более слабым основанием, чем алкиламины и типичные алифатические третичные амины. Это водорастворимая и легковоспламеняющаяся жидкость с неприятным "рыбоподобным" запахом. Хотя чистый пиридин не имеет цвета, нечистые или старые образцы могут казаться желтыми.
Это основание в основном используется для растворения других соединений и изготовления различных продуктов, включая красители, краски, инсектициды, лекарства, пищевые ароматизаторы, витамины, клеи и резиновые изделия. Оно также содержится во многих природных материалах в окружающей среде.
6. Этиламин
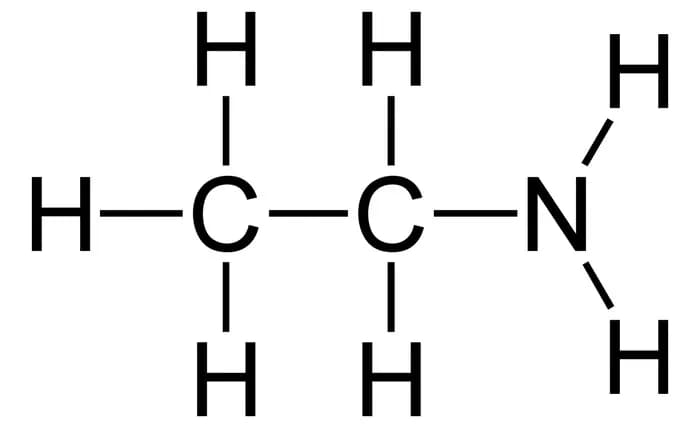
Формула: C2H5NH2
Основность (pKb): 3,35
Этиламин - это коррозийный первичный амин. Он является слабым основанием, что означает, что он не ионизируется полностью в водном растворе с образованием катионов этил-аммония и анионов гидроксида.
Равновесие устанавливается между неионизированными молекулами этиламина и двумя ионами, которые образуются в результате его ионизации.
Как и другие первичные амины, этиламин является отличным растворителем для металлического лития. Эти растворы используются для восстановления ненасыщенных органических веществ, таких как алкины и нафталины.
Кроме того, этиламин образует токсичные оксиды азота при сгорании. Обычно его хранят в закрытом контейнере; однако длительное воздействие высоких температур может привести к его резкому разрыву.
5. Пропиламин
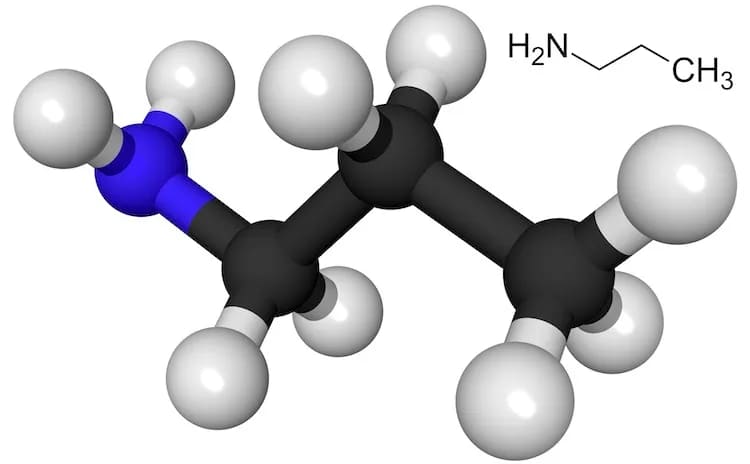
Формула: C3H7NH2
Основность (pKb): 3,45
Пропиламин относится к классу органических соединений, называемых моноалкиламинами. Эти соединения содержат первичную алифатическую аминную группу.
Пропиламин растворим в воде и имеет меньшую плотность, чем вода. Это бесцветная летучая жидкость, а его пары тяжелее воздуха. При сгорании он образует токсичные оксиды азота.
Пропиламин обычно содержится в меньшей концентрации в нескольких различных продуктах питания, таких как зеленый болгарский перец, оранжевый болгарский перец, и в наибольшей концентрации в красном болгарском перце и желтом болгарском перце. Исследователи также обнаружили его в диком сельдерее и обычном винограде.
В лаборатории гидрохлорид пропиламина получают путем смешивания хлорида аммония с 1-пропанолом при высоком давлении и температуре с использованием катализатора кислоты Льюиса, например, хлорида железа.
Пропиламин в основном используется для синтеза и анализа других химических веществ.
4. Гидроксид аммония

Формула: NH4OH
Основность (pKb): 4,75
Хотя гидроксид аммония является соединением природного происхождения, он также производится человеком по ряду причин. Он изготавливается путем растворения аммиака в воде. Полученная жидкость бесцветна и имеет резкий запах.
Раствор содержит значительное количество воды и аммиака и меньшее количество иона аммония и гидроксид-иона. Поскольку гидроксид аммония не полностью диссоциирован на ионы, он является слабым основанием. Его pH колеблется между 7 и 10.
У этого соединения есть несколько применений. Например, в продуктах питания гидроксид аммония используется в концентрации 0,7%, тогда как бытовые чистящие средства производятся с концентрацией 5-10%. Он также используется в обычном качественном неорганическом анализе в качестве комплексообразователя и основания.
3. Метиламин
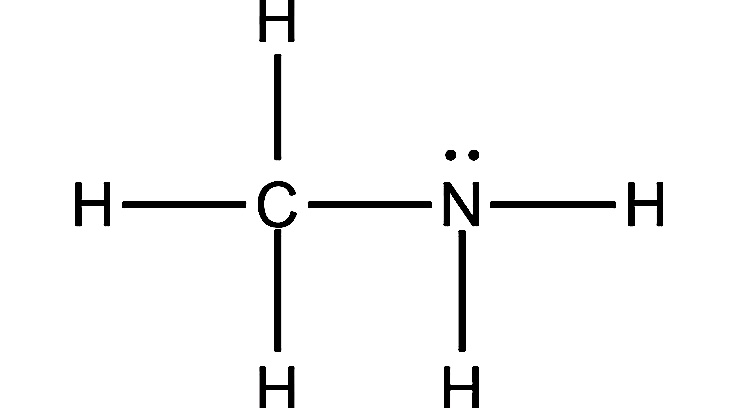
Формула: CH3NH2
Основность (pKb): 3,34
Метиламин - это обычный алифатический первичный амин, в котором NH2 соединен с углеродной цепью. Все алифатические первичные амины, включая этот, являются более сильными основаниями, чем аммиак.
Как видно из формулы, основное различие между аммиаком и метиламином заключается в наличии у последнего группы CH3. Поскольку алкильная группа отталкивает электроны от себя, на атоме азота накапливается небольшой отрицательный заряд, что делает его одинокую пару еще более привлекательной для ионов водорода.
А поскольку аммиак не имеет электронодонорной группы, он является более слабым основанием, чем метиламин (в котором азот имеет более отрицательный заряд, поэтому он охотнее принимает H+).
Как и аммиак, метиламин представляет собой бесцветный газ или жидкость с резким запахом. Он может легко загореться. При длительном воздействии высоких температур емкости с метиламином могут разорваться. Поэтому обращаться с ним нужно осторожно.
Метиламин продается в основном в виде раствора в тетрагидрофуране, этаноле, метаноле или в виде безводного газа в контейнерах под давлением. Он широко используется для производства пестицидов, поверхностно-активных веществ, фармацевтических препаратов, растворителей краски и химических веществ для резины.
2. Анилин

Формула: C6H5NH2
Основность (pKb): 9,13
Анилин - это простейший ароматический амин, представляющий собой желто-коричневатую маслянистую жидкость с затхлым рыбным запахом. Он содержит амин, присоединенный к бензольному кольцу.
Более конкретно, одинокая пара над атомом азота в группе NH2 находится в сопряжении с электроном Pi бензольного кольца. Поэтому анилин не может легко потерять электронную пару, что делает его слабым основанием.
Он хорошо растворим в спирте и эфире и слабо растворим в воде. При реакции с сильными кислотами он образует ионы анилиния.
Анилин токсичен в природе. Он быстро всасывается в кожу, легкие и желудочно-кишечный тракт подопытных животных. Однако он широко используется для синтеза химических веществ, особенно сельскохозяйственных, фотохимикатов и красителей.
1. Аммиак

Формула: NH3
Основность (pKb): 4,75
Аммиак обладает большой способностью образовывать водородные связи. Когда он растворяется в воде, он получает ионы водорода из воды, образуя ионы аммония и гидроксида.
NH3(aq) + H2O <–> NH4+(aq) + OH–(aq)
Эта реакция протекает в обоих направлениях, что означает ее обратимость. В любой момент реакции почти 99% вещества все еще остается в виде молекул аммиака, и только 1% действительно производит гидроксид-ионы. Поскольку лишь небольшая часть аммиака превращается в гидроксид-ионы в растворе, он является слабым основанием.
Аммиак - это строительный химикат, используемый для производства широкого спектра продуктов. Около 90% аммиака, производимого в мире, используется в удобрениях для улучшения производства продуктов питания для миллиардов людей. Остальная часть используется в резиновой и бумажной промышленности, очистке сточных вод и производстве бытовых чистящих средств.