10 Самых сильных оснований когда-либо синтезированных

Основание, в химии, относится к любому веществу, которое высвобождает гидроксидные ионы (OH − ) при растворении в воде или водном растворе. Многие основания, однако, не легко переносят гидроксидные ионы, но они также производят высокие уровни OH − при обработке водой. Этот тип реакции можно наблюдать, когда аммиак обрабатывают водой с получением аммония и гидроксида.
Основания также имеют отличительные физические характеристики; например, они горьки на вкус (кислоты кислы) и дают скользкое ощущение при прикосновении. Основы необходимы и являются жизненно важным компонентом в конкретных отраслях промышленности. Они использованы для того чтобы сделать бумагу, мыло и синтетическую вискозу, порошок отбеливания, антацид. Хотя они обычно рассматриваются как химическая противоположность кислот, есть несколько известных кислот, которые могут вести себя так же, как основания при определенных обстоятельствах.
Как и кислоты, основания могут быть сильными или слабыми. Сильное основание - это просто химическое соединение, которое полностью распадается (диссоциирует) на воду и образует гидроксид-ион. Обычными примерами сильных оснований являются NaOH (гидроксид натрия) и Ca (OH) 2 (гидроксид кальция). Принимая во внимание, что слабое основание диссоциирует в воду только в определенной степени.
Cверхоснование
Cверхоснование - это мощные химические соединения, которые имеют чрезвычайно высокое сродство к протонам и сильнее, чем ионы водорода. Cверхоснование используются для органического синтеза и являются важным компонентом физической органической химии.
Термин «сверхоснование» не нов и использовался более полутора столетий. Поскольку сверхоснование подвержены бурной реакции, при контакте с водой или углекислым газом для проведения химических реакций требуется специальный растворитель. Сверхоснование могут быть классифицированы на три типа; органические, неорганические и металлоорганические. Ниже приведен список 10 сильнейших баз на Земле.
10. Гидроксид лития
Химическая формула: LiOH
Первое место в списке занимает гидроксид лития - белое кристаллическое вещество (в безводной форме) с высоким уровнем растворимости в воде и коррозионной природой. Это также самый слабый из всех известных гидроксидов щелочных металлов. Гидроксид лития образуется путем индуцирования реакции между гидроксидом кальция и карбонатом лития в реакции метатезиса соли.
Li 2 CO 3 + Ca (OH) 2 → 2 LiOH + CaCO 3
Большое количество LiOH используется для производства литиевого мыла. Другое важное использование гидроксида лития делается в вентиляционных системах подводных лодок и космических аппаратов для устранения углекислого газа путем создания воды и карбоната лития.
2 LiOH + CO 2 → Li 2 CO 3 + H 2 O
Он также используется в качестве средства борьбы с коррозией в ядерных реакторах (реактор с водой под давлением) и в качестве электролита батареи.
9. Гидроксид натрия
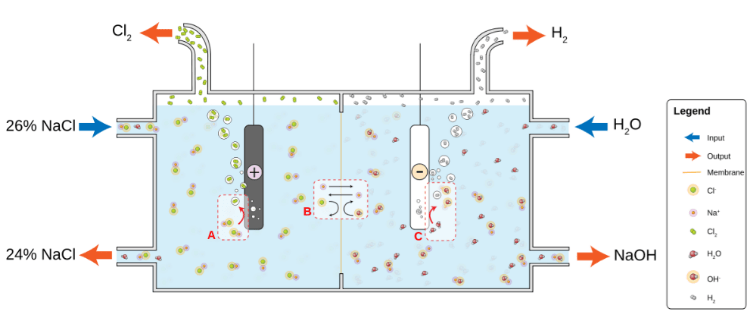
Химическая формула: NaOH
Гидроксид натрия, широко известный как каустическая сода, представляет собой ионное соединение, которое несет катионы натрия Na+ и гидроксид-анионы OH - . NaOH известен своей чрезвычайно агрессивной природой, особенно при комнатной температуре, поскольку он может быстро разлагать белки. Он способен привлекать (поглощать) CO2 и влагу из воздуха.
Гидроксид натрия широко используется для химической варки целлюлозы в бумажной промышленности. Его другие применения включают в себя производство мыла и моющих средств, обработку сырой пищи, производство цемента и водоочистные сооружения для нейтрализации значений pH воды. Он также время от времени используется в нефтяной промышленности для нейтрализации кислот и повышения уровня щелочности определенного раствора.
В древние времена NaOH получали обработкой гидроксида кальция карбонатом натрия. К 19 веку его заменил процесс Сольвея, который использовался для производства карбоната натрия, дешевой альтернативы NaOH. Сегодня большая часть промышленного гидроксида натрия создается с помощью процесса хлоралкалия.
8. Гидроксид калия

Химическая формула: KOH
Многие из вас могут распознать гидроксид калия как едкий калий, твердое белое вещество, известное своей высококоррозионной природой. Подобно гидроксиду натрия, KOH является бесцветным (коммерчески доступно в белом цвете) и прочным квинтэссенцией.
В то время как гидроксид калия и гидроксид натрия могут использоваться как взаимозаменяемые вещества для различных целей, в большинстве отраслей промышленности используется NaOH, так как он дешевле двух. В любом случае он используется для производства биодизеля, мыла и в качестве электролита в некоторых батареях.
Чистый гидроксид калия получают взаимодействием гидроксида натрия с деградированным или нечистым калием. Химическое соединение потенциально опасно и вызывает ожоги кожи при концентрации более 2%. Все, что от 0,5% до 2%, может вызвать сильное раздражение.
7. Бис(триметилсилил) амид лития
Химическая Формула: C 6 H 18 LiNSi 2
Бис (триметилсилил) амид лития, или сокращенно LiHMDS, представляет собой ненуклеофильную супероснову, которая имеет важные применения в лабораториях. Как и другие реагенты на основе лития, он может образовывать циклические соединения с тримером, анионом, созданным комбинацией трех ионов одного и того же вещества. LiHMDS обычно получают взаимодействием бис (триметилсилил) амина с бутиллитием.
HN (SiMe3) 2 + C4H9Li → LiN (SiMe3) 2 + C4H10
6. Гидрид натрия
Химическая формула: NaH
Гидрид натрия принадлежит к особой группе гидридов, известных как солевые/ионные гидриды (состоящие из ионов Na+ и H-), которые, в отличие от аммиака и воды, существуют в солеобразной форме. В основном он используется в качестве основы органического синтеза, хотя известно также малое количество незначительных случаев использования NaH. Гидрид натрия образуется при реакции водорода с жидким натрием.
Чистый гидрид натрия бесцветен, но коммерческие образцы могут иметь серый цвет. Более того, NaH примерно на 40% плотнее, чем его предшественник - химическое соединение натрия.
В редких случаях соединение может принимать форму "обратного гидрида натрия", где натрий и ионы водорода обмениваются зарядами (Na- и H+). Na- является щелочью, что делает это соединение более энергетическим, чем стандартный гидрид натрия (из-за увеличенного чистого смещения между двумя электронами).
NaH является пирофорным по своей природе. Он также интенсивно реагирует с водой и при гидролизе образует гидроксид натрия - коррозионное вещество.
5. Амид Натрия
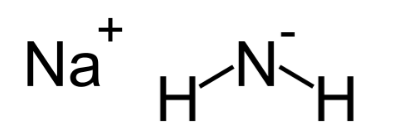
Химическая формула: NaNH 2
Азид натрия, иногда известный как Амид натрия, является одним из самых сильных известных оснований в мире. Это важное, коммерчески доступное химическое соединение, которое обычно используется в органическом синтезе. NaNH 2 проводит электричество (в сплавленном состоянии), так как его электрические свойства проводимости почти аналогичны свойствам гидроксида натрия.
В то время как чистый гидроксид натрия обычно белый, большая часть коммерчески доступных NaNH 2 имеет серый цвет из-за наличия примесей в виде металлического железа. Обычно Амид натрия получают путем взаимодействия аммиачного газа с натрием.
2 Na + 2 NH3 → 2 NaNH2 + H2
Амид натрия является предпочтительным в некоторых типах синтеза из-за его функций в качестве нуклеофила. Это потенциально опасное химическое вещество, с которым следует обращаться с особой осторожностью. Он может энергично реагировать с водой, особенно когда присутствует в твердой форме.
4. Диизопропиламид лития
Химическая формула: C 6 H 14 LiN
Следующим в списке является диизопропиламид лития, еще одна ненуклеофильная сверхоснова, которая известна своей сильно коррозионной природой и растворимостью. В нормальных условиях соединение синтезируется путем обработки охлажденного раствора диизопропиламина (тетрагидрофурана) Бутиллитием. Излишне говорить, что диизопропиламид лития является коррозионным, а пирофорные, но коммерческие растворы гораздо безопаснее.
3. Бутиллитий

Химическая формула: C 4 H 9 Li
Н-Бутиллитий коммерчески важное свероснова, главным образом используемое как катализатор для полимерности для того чтобы произвести синтетический каучук. Он также используется в фармацевтической промышленности. Хотя бутиллитий в основном бесцветный, он может претерпевать незначительные изменения цвета либо при контакте с алканами, либо при старении.
Помимо сверхосновы, Н-Бутиллитий является мощным восстановителем, а также нуклеофилом (химическое вещество, которое жертвует электронную пару, образуя связь). Бутиллитий обычно получают взаимодействием лития с 1-бромбутаном или 1-хлорбутаном.
2 Li + C 4 H 9 X → C 4 H 9 Li + LiX
Бутиллитий нестабилен и может активно реагировать с водой и углекислым газом, но его можно безопасно хранить под инертным газом.
2. Анион окиси лития
Химическая формула: LiO -
E pa : 1782 кДж / моль -1
Анион монооксида лития когда-то был самой сильной основой в мире до того, как был свергнут с престола в 2008 году. Как и другие сверхосновы, монооксид лития готовят в апротонном растворителе и также известен своей чрезвычайно агрессивной природой.
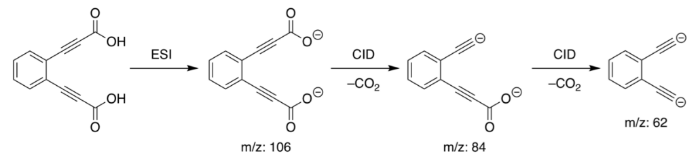
Синтез аниона моноксида лития является сложной процедурой, и ее сложно проводить контролируемым образом. Обычно небольшое количество оксалата лития (Li 2 C 2 O 4 ) используется в качестве предшественника, который проходит процесс ионизации электрораспылением. Полученное соединение оксалат-анион лития (LiC 2 O 4 ) выделяют и затем обрабатывают с индуцированной столкновением диссоциацией дважды.
В результате получаем анион оксида лития (LiO-) и молекулу диоксида углерода. Использование аниона оксида лития неизвестно.
1. Орто-diethynylbenzene дианион
Химическая формула: [C 6 H 4 (C2) 2 ] 2–
E pa: 1843 кДж / моль
Орто-diethynylbenzene дианион является, пожалуй, самым сильным сверхоснованием, известным нам. Он был первоначально синтезирован/открыт группой исследователей в Австралии с использованием масс-спектрометрии.
Как и другие сверхосновы, орто-diethynylbenzene дианион может удерживаться только в газовой фазе. Это, однако, создает идеальные условия для более точного измерения его основности. Расчеты показали, что Орто-diethynylbenzene дианион имеет протонное сродство 1843 кДж/ моль -1 намного больше, чем гидроксид (1633,14 кДж/моль).
Кроме того, орто-diethynylbenzene имеет два изомера (с одинаковой молекулярной формулой, но различной химической структурой); Мета-диэтинилбензол дианион и пара-диэтинилбензол дианион, второе и третье сильнейшее основание, когда-либо синтезированное. Оба изомера, включая орто-diethynylbenzene, не имеют известного применения и существуют в газообразном состоянии.